1. Poliüretanlar ve Biyomedikal Kullanım Alanları
Poliüretanlar tekrarlayan üretan grupları içeren bir polimer türüdür (1). Üretan bağları, izosiyanatların ve polialkollerin reaksiyonu ile oluşur. Poliüretanların hazırlanması ve sertleştirme işlemleri sırasında, üretan bağlarının oluşumunun yanı sıra birçok farklı reaksiyonlarda meydana gelir. Bu reaksiyonlar allofanat, biüre, asilüre ve izosiyanürat gibi çeşitli bağlar oluşturarak daha fazla dallanma ve çapraz bağlanmaya yol açar (2, 3). Poliüretan malzemelerin nitelik, mukavemet ve hatta biyouyumluluk gibi özelliklerini artırmak için başka bir polimer malzemeyle dönüştürülmeleri oldukça yaygın bir uygulamadır. Polimer kompozit malzemeler, önemli ölçüde farklı fiziksel veya kimyasal özelliklere sahip iki veya daha fazla bileşenden üretildiğinden, tek tek bileşenlerden farklı üstün özelliklere sahiptir. Kullanılan her malzeme kompozit yapı içinde ayrı ve farklı kalır (4). Ayrıca, son zamanlarda yenilenebilir kaynaklardan elde edilen polioller (polisakkaritler, proteinler, antioksidanlar vb.) kullanılarak poliüretan temelli malzemelerin hazırlanması geniş bir şekilde araştırılmaktadır (Şekil 1).
[caption id="attachment_105153" align="aligncenter" width="486"]
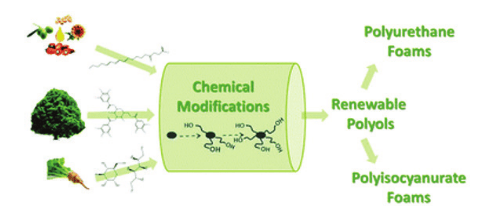
Şekil 1. Yenilenebilir kaynaklar kullanılarak biyotemelli poliüretan malzemelerin sentezi (5)[/caption]
Kapsamlı bir yapı ve nitelikleri bakımından çeşitliliğe sahip poliüretanlar günümüzde bilinen biyouyumluluğu yüksek malzemelerden biridir. Çalışma yelpazesinin de geniş olmasıyla beraber, malzemeyle alakalı kritik noktalar vardır (6).
Vücutta toksik etkilere neden olabilecek çözücü, monomerler, zincir genişleticiler veya diğer kimyasallar olmamalıdır. Dayanıklılık, elastikiyet, elastomer benzeri karakter, yorulma direnci, uyum ve iyileşme sırasında biyouyumluluk gibi özellikler bulundurmalıdır (7, 8). Bu özelliklerin birçoğunu taşıyan poliüretanlar, doku mühendisliği, yara örtü malzemeleri, kardiyovasküler tedavi, ilaç taşıyıcı sistemler ve enzim immobilizasyonu gibi çeşitli biyomedikal alanlarda kullanılmaktadırlar (9).
2. Enzim İmmobilizasyonu
Enzimler, yüksek özgüllük ve aktivasyon ile karakterize edilen, biyomoleküllerin çeşitli işlemlerini oldukça etkili ve verimli bir şekilde gerçekleştiren katalizörler olarak bilinirler (10). Substratlarına olan yüksek özgüllüğü, üretim kolaylığı, çevre dostu olması nedeniyle biyomedikal, gıda ve endüstriyel alan gibi çeşitli alanlar tarafından kullanılmaktadır (11). Enzimleri çalışma alanlarının yaygın olması, enzim özelliklerinin iyileştirilmesi için yeni tekniklerin gelişmesine yol açmıştır. Bu tekniklerden en önemlisi enzimlerin, reaksiyon ortamında çözünmeyen katı bir desteğe bağlanması temeline dayanan enzim immobilizasyonudur (12). İmmobilizasyonun diğer yöntemlere kıyasla en büyük avantajı, çeşitli reaksiyon koşulları altında enzimlerin stabilitelerini önemli ölçüde geliştirebilmeleri ve ardışık katalitik döngülere dayanıklı olup yeniden kullanılabilirliğinin artmasıdır (13). Enzim immobilizasyonu için matriks veya destek sistemi olarak, genellikle inert polimerler ve inorganik malzemeler kullanılırlar. İdeal taşıyıcı matriksin sahip olması gereken bazı özellikler vardır. Bunlar, ekonomik olması, eylemsizlik, stabilite, enzim aktivitesini artırma yeteneği, yenilenebilirlik, spesifik olmayan adsorpsiyon ve bakteriyel kontaminasyonu önleme yeteneği olarak sıralanabilir.
Biz bu makalede yüksek mekanik özellikleri ve biyouyumlulukları nedeniyle poliüretanların enzim immobilizasyonunda kullanımları üzerinde duracağız. Enzim immobilizasyonunda poliüretanlar kullanılarak hazırlanmış çalışmalar ‘Poliüretan Temelli Materyallerin Enzim İmmobilizasyonunda Kullanımları’ başlığı altında sunulmuştur.
[caption id="attachment_105154" align="aligncenter" width="666"]

Şekil 2. Lakkaz immobilize edilen Fe (III)-PU/AOPAN/β-CD nanofiber membranın hazırlanması için ayrıntılı prosedürü gösteren şematik gösterim (14)[/caption]
Çeşitli deneylerden sonra elde edilen sonuçlar lakkaz enziminin nanofiber membran üzerine başarılı bir şekilde immobilize edildiğini göstermektedir. Lakkazın immobilizasyon miktarı 186,34 mg/g gibi yüksek bir değere ulaşmış ve mükemmel katalitik aktivite sergilemiştir. Ayrıca immobilize lakkaz serbest lakkaza oranla sıcaklık ve pH gibi parametrelerdeki değişikliklere karşı önemli ölçüde direnç göstermiştir. Enzim immobilizasyonu için kullanılan diğer taşıyıcılarla kıyaslandığında, PU/AOPAN/β-CD nanofiber membranın çok daha yüksek mekanik özelliklere, morfolojik stabiliteye ve rejenerasyon kapasitesine sahip olduğu gözlenmiştir. Bu sonuçlar göz önüne alındığında PU/AOPAN/β-CD karışımı nanofiber membranın enzimlerin immobilizasyonu için yenilikçi ve yüksek performanslı bir taşıyıcı destek malzemesi olduğunu söyleyebiliriz (14).
Bresolin ve arkadaşları yapmış oldukları çalışmada ise yeşil sentez yöntemiyle hazırlamış oldukları poliüretan köpüklere (PUF) lipaz enzimini immobilize etmeyi hedeflemişlerdir. İlk olarak hint yağı ve gliserol arasında enzimatik gliseroliz yoluyla PUF elde etmişlerdir. Daha sonrasında lipazın immobilizasyonu için destek materyali olarak kullanmışlardır. İmmobilizasyon verimi yaklaşık %94 olarak bulunmuştur. İmmmobilize edilmiş olan lipaz ve serbest lipaz farklı çözücülerde (metanol, etanol, propanol), pH değerlerinde, sıcaklıklarda ve çeşitli iyonların (Na+, Mg2+, Ca2+) varlığında test edilmiştir. Farklı pH koşullarında serbest lipaz aktivitesinin %80’nini kaybederken immobilize lipaz %22’sini kaybetmiştir. Yüksek sıcaklık koşullarında ise serbest enzim aktivitesinin %50’sini kaybederken immobilize lipaz aktivitesinin %95’ini korumuştur. Bunlara ek olarak çözücülerin varlığında serbest lipaz, metanol ve etanole karşı daha toleranslı iken immobilize lipaz propanole karşı daha toleranslı olduğu gösterilmiştir.
[caption id="attachment_105155" align="aligncenter" width="708"]

Şekil 3. Sentezlenen poliüretan malzemelerin şematik gösterimi (16)[/caption]
Yapılan deneyler sonucunda immobilize lipaz 25 günlük depolamadan sonra bile başlangıç aktivitesinin %95,298.6’sını korumuştur. Ayrıca en iyi sonuçlar %90 immobilizasyon verimi ve maltogenaz adsopsiyon yöntemi ile AuNP’lerinde sağlanmıştır. Bunlara ek olarak AuNP’ler Ag-NP’lere oranla kümelenmeye daha az katılım göstermişlerdir. Tüm bunlar göz ününe alındığında PU metal konjugatlarının enzim immobilizasyonu için elverişli bir materyal olduğu düşünülebilir (16).
Cui ve arkadaşları lipazı farklı modifikasyonlarla PUF üzerinde immobilize etmek için etkili bir yöntem geliştirmişlerdir. İlk olarak PUF yüzeyindeki aktif grupları açığa çıkarmak için HCl ile muamele edilmiştir ve PUF–HCl üzerinde immobilize edilen lipazın PUF’a oranla daha yüksek aktivite sergilediği gözlenmiştir. Daha sonra PUF-HCl, AA/Polietilenimin (PEI) ile modifiye edilmiştir. PEI birincil, ikincil ve üçüncül amino grupları içeren geniş bir aralıktaki koşullar altında güçlü bir anyon değişim kapasitesine sahip ve bir enzim veya destek üzerindeki farklı parçalarla reaksiyona girme yeteneğine sahip bir polimerdir. Lipazın izoelektronik noktası pH 5.4‘te olduğundan PUF-HCl-AA/PEI ile kolaylıkla immobilize edilmiştir. Yapılan işlemler Şekil 4’te gösterilmektedir.

Elde edilen sonuçlara göre en yüksek aktivite PUF-HClAA/PEI’ da gözlenmiştir. PUF-HCl -AA/PEI’da gözlenen aktivite başlangıçtaki oran 2,41 katı olarak bulunmuştur. Son olarak immobilize edilmiş lipaz, A vitamini palmitatın sentezi için kullanılmıştır. İmmobilize lipazın 3L’lik bir biyoreaktörde 12 saat boyunca %90’ın üzerinde bir dönüşüm oranıyla 18 defaya kadar kullanılabildiği gözlemlenmiştir.
Sonuç olarak bu çalışma orta dereceli bir poliüretan mikro ortamının, immobilize lipaz aktivitesini ve stabilitesini artırmak için önemli olduğunu göstermektedir (17).
Facin ve arkadaşları yapmış oldukları çalışmada PUF üzerinde Thermomyces lanuginosus lipaz immobilizasyonunun farklı yöntemleri araştırılmıştır.
PU polimer, monomer olarak polieter ve toluen diizosiyanat kullanılarak sentezlenmiş ve lipaz immobilize edilmiştir. İmmobilizasyon işleminden önce ve sonra PU matrisi, çeşitli yöntemlerle karakterize edilmiştir. İmmobilize enzim 24 saat boyunca pH (7 ve 9), sıcaklık (24, 50 ve 60oC) aralığında stabilite ve 30 gün boyunca %80 aktivitesini koruyarak depolama kararlılığı sergilemiştir. Bu çalışmadan elde edilen sonuçlar immobilizasyon verimi açısından en iyi sonuçların yakalama yöntemi ve ligant ajanı olarak dopamin kullanılarak kovalent bağlama ile elde edilmiştir.
Hem serbest hem de immobilize enzim için benzer Vmax ve Km sonuçları immobilizasyon işleminin enzim affinitesini etkilemediğini göstermiştir. Ayrıca sıcaklık pH çözücü ve depolama stabilitesi ile ilgili olarak, PU temelli destekte immobilize edilmiş lipazın serbest enzime benzer sonuçlar verdiği gözlenmiştir. Soya fasulyesi yağı hidrolizinde immobilize enzimin uygulanması ve kullanılması, beş yeniden kullanım döngüsüne izin vermiştir. Bu nedenle PU sıcaklık ve pH’a karşı enzim özelliklerini iyileştirmemesine rağmen, immobilizasyon için düşük maliyetli bir matris olarak düşünülebilir (18).
Cipolatti ve arkadaşları yapmış oldukları çalışmada PU polietilen glikol (PEG) ile mini emülsiyon polimerizasyonunu kullanarak sentezlemiş ve enzim immobilizasyonu için bir destek materyali olarak sunmuşlardır. Enzim destek materyali olarak kullanılmasında molar ağırlığının ve PEG konsantrasyonunun etkisini incelemek için üç farklı molekül ağırlığına sahip PEG (400, 4000 ve 6000 Da) kullanılmıştır.
Daha sonra Thermomyces Lanuginosus lipazı (TLL) immobilize edilmiştir. TLL-PU-PEG6000 immobilize sistem yüksek katalitik sonuçlar göstermiştir. 50ºC’de ve daha geniş bir pH aralığında stabilite göstermiş ve yüksek bir etil ester üretimine yol açmıştır. Enzim immobilizasyonu ve PEG’in molekül kütlesi arasındaki ilişki Tablo 1’de gösterilmektedir.

Sonuç olarak TLL-PU-PEG 6000’in etil ester üretiminde en yüksek değerlere sahip olduğundan, çözücüsüz sistemlerde etanoliz reaksiyonları için potansiyel bir düşük maliyetli katalizör olduğunu söyleyebiliriz (19). Creczynski-Pasa ve arkadaşları yapmış oldukları çalışmada PEG NPs ile fonksiyonelleştirerek saflaştırılmış yaban turpu peroksidazı (HRP) immobilize etmişlerdir. İmmobilizasyon işleminin katalitik aktivitesi üzerindeki etkisi ve işlem morfolojik analizler ile değerlendirildi. HRP’nin PU-PEG NPs üzerinde immobilizasyon işlemi, beklendiği gibi enzimin yeniden kullanılabilirliğini artırdı. Ayrıca 50 günlük depolamadan sonra orijinal aktivitenin %50’sini korunduğu gözlendi. Şekil 5 PU-PEG’e immobilize edilen HRP’nin şematik gösterimidir.

Bu çalışmada geliştirilen modifiye karbon elektrotile dopamin geri kazanımı %97 ile %107 arasına olup, yaklaşık 2 dakikalık toplam test süresi, hazırlanmasının kolaylığı ve 400 tayine kadar kullanılabilirliği açısından büyük önem taşır.
Son olarak PU-PEG NPs’lerin enzim immobilizasyonu için uygun bir materyal olduğunu ve de dopamin tayinin düşük limitlerde bile tespiti için karbon elektrodun kullanımının son derece avantajlı olduğunu söyleyebiliriz (20).
Hooda ve arkadaşları yapmış oldukları çalışmada Vigna mungo’dan saflaştırılmış kitinaz ve Canavalia ensiformis’ten saflaştırılmış N-asetil B-glukoaminidaz’ı, PU/çinko oksit NPs kompozit matriks üzerinde sırasıyla 0.785 ve 96.19’luk bir konjugasyon verimi ve spesifik aktivitenin tutulmasıyla immobilize etmişlerdir.
Yapısal ve morfolojik analizler PU matris üzerinde ZnO NPs’nin ve enzimlerin varlığını doğrulamıştır. Sentezlenen PU/ZnO/Kitinaz/NAGase konjugatının optimum sıcaklık, pH ve substrat konstarasyonları belirlenerek buğday tanelerinde kitin tayini için, optik bir biyosensör olarak kullanılmıştır. Saptama sınırı, 0.1 ila 10 mM doğrusallık ile 0.01 mM olarak bulunmuştur. Eklenen kitinin geri kazanım yüzdesi yaklaşık olarak %95 ile %96,5 arasında olarak bulunmuştur.
Bu yöntem 3,5-dinitrosalisilik asit yöntemi ile iyi bir korelasyon göstermiştir. PU/ZnO/kitinaz/NAGaz, iyi termal ve stok stabiliteleri göstermiş ve kayda değer bir aktivite kaybı olmadan 10 kez yeniden kullanılabilir olduğu tespit edilmiştir.
[caption id="attachment_105159" align="aligncenter" width="657"]

Şekil 6. Kitinaz/NAGaz’ın PU/nano ZnO kompozit üzerinde birlikte immobilizasyonu. PU üretan grupları ile enzimin amin ve/veya hidroksil grupları arasındaki reaksiyon kutuda gösterilmektedir (21)[/caption]
Özetleyecek olursak, iki kitinolitik enzim kitinaz ve NAGaz, PU/ZnO nano hibrit desteği üzerinde birlikte immobilize edilmiştir ve depolanan buğday tanelerinde kitin içeriklerinin belirlenmesi için absorpsiyon bazlı optik biyosensör geliştirmek ve emmek için kullanılmıştır. Aktivite için daha geniş pH ve sıcaklık aralığı, kinetik parametreler için kabul edilebilir değerler ve PU/ZnO/Kitinaz/NAGaz konjugatlarının serbest enzimlerle eşleştirilmiş olarak geliştirilmiş termal ve depolama kararlılıkları da desteğin uygunluğunu doğrulanmıştır. Konjugatların depolanmış buğday irmiklerinde kitini algılama etkinliği, analitik geri kazanım, varyasyon katsayısı ve belirleme katsayısı için tespit sınırındaki ve kabul edilebilir değerlerdeki önemli iyileştirmelerle kanıtlanmıştır. Genel olarak, kitin tayini için sonuçlar tutarlı, güvenilir ve tekrarlanabilirdi. Bu yöntemin herhangi bir karmaşık araç kullanmadan ve rutin temelde tahılların ürünlerinin kalitesini kontrol etmek için uygun şekilde kullanılabileceğini söyleyebiliriz (21).
Migliardini ve arkadaşları yaptıkları çalışmada biyomimetik yaklaşımdan yola çıkarak, PUF’a Karbonik anhidraz (CA, EC 4.2.1.1) immobilize edip, ilginç bir CO2 yaklaşım, CO2 yakalama stratejisi geliştirmişlerdir. Biyomimetik ’i metabolik yollardan veya Karbonik Anhidraz gibi bir enzim kullanarak sabitleyen mikroorganizmaları kullanır. Yapmış olan çalışmada kullanılan SspCA adlı CA enzimi Sulfurihydrogenibium yellowstonense’den saflaştırılmıştır. SspCA bir PUF üzerine immobilize edilerek, bir enerji santrali uygulamasına yakın koşullarda CO2 tutma kapasitesini doğrulamayı amaçlayan deneysel testler için PU-SspCA içeren bir biyoreaktör kullanıldı.
Bu biyoreaktörde, CO2 içeren bir gaz fazı, gaz fazında bulunan CO2’in absorbe edildiği ve CA tarafından verimli bir şekilde bikarbonata dönüştürüldüğü koşullar altında bir sıvı faz ile temas ettirilmiştir. PUF üzerine immobilize edilen enzimin 100ºC aktivitesini koruyarak ve 50 saate kadar stabil olduğu gözlenmiştir. Ayrıca oda sıcaklığında 1 ay boyunca kararlığını korumuştur. Bunlara ek olarak PU-SspCA makalede bildirilen biyoreaktörde kullanıldığında iyi bir CO2 yakalama performansı göstermiştir. Bu sonuçlar göz önüne alınırsa termostabil PU-SspCA’ın biyomimetik yaklaşımla CO2 idrasyonu için güçlü bir aday olduğunu göstermektedir. (22)
4. Tartışma ve Sonuç
Enzimler biyomedikal alandan endüstriyel alana kadar kullanımları oldukça yaygın biyomoleküllerdir. Fakat kullanım maliyetlerinin yüksek oluşu, tekrar kullanılamamaları, çevre koşullarından etkilenmeleri gibi nedenler enzimlerin stabilizasyonunu sağlayacak ve kullanım koşullarını iyileştirecek yeni stratejileri beraberinde getirmiştir. Makalede incelemiş olduğumuz literatür çalışmalarından da gördüğümüz üzere poliüretan matris veya destek malzemelerine enzimlerin immobilize edilmesi enzimlerin stabilize edilmesinde oldukça önemli bir yöntemdir. Poliüretanların yüksek mekanik özellikleri, biyouyumlulukları immobilize edilen enzimlerin endüstriyel ve biyomedikal alanda kullanımlarını elverişli hale getirir. Bu nedenle poliüretan malzemelerinin tek başına, çeşitli polimer veya nanomalzemelerle kompozit hale getirilerek enzim immobilizasyonu üzerine yapılan çalışmalar artarak devam etmektedir.
Kaynakça 1. Wang, W., Wang, C. Polyurethane for biomedical applications: A review of recent developments. The Design and Manufacture of Medical Devices, Woodhead Publishing Reviews: Mechanical Engineering Series (2012) 115-151. 2. Burke, A., Hasırcı, N. Advences in Experimental Medicine and Biology, 553 (2004), 83-101. 3. Burke, A., Hasırcı, N. Biomaterials, 1994, 81-90. 4. Członka, S., Strąkowska, A., Strzelec, K., Kairytė, A. Kremensas, A. 13 (2020) 1108. 5. Ates B, Koytepe S. Balcıoglu S, et al., International Journal of Adhesion and Adhesives, (2019), 95, 102396. 6. Hasırcı, N., Hasırcı, V. Biomaterials: From Molecules to Engineered Tissue (1993), 38-41. 7. J W Boretos and W S Pierce, Journal of Biomedical Materials Research, 2 (1968) 121-130.
8. Boretos, J. W, Concise Guide to Biomedical Polymers, Their Design Fabrication and Molding, 1973, 179. 9. Shukla P.G., et al., Journal of Microencapsulation Micro and Nano Carriers, 19 (2002) 293-304. 10. Zdarta, J. et al., Catalysts 8 (2018) 92. 11. Cowan, D.A., Fernandez-Lafuente, R., Enzyme and Microbial Technology, 49 (2011) 326–346. 12. Jesionowski, T. et al., Adsorption, 20 (2014) 801– 821. 13. Zhang Y. Ge, J. and Liu, Z., ACS Catalysis., 5 (2015) 4503–4513. 14. Dingsheng Wu et al., Chemical Engineering Journal, 331 (2018) 517-526. 15. Daniela Bresolin et al., Bioprocess and Biosystems Engineering., 42 (2019) 213-222. 16. Kochane et al. Colloids and Surfaces A: Physicochemical and Engineering Aspects, 532 (2017) 436443. 17. Cui, C., Li, L., Li, M. Biochemistry & Biotechnology, 49 (2019) 485–492. 18. Facin, B. R., Valério, A., Bresolin, D., Oliveira, V., Oliveira, j. V., Biocatalysis and Biotransformation, 36 (2018) 372–380. 19. Cipolatti et al., Journal of Molecular Catalysis B: Enzymatic, 122 (2015) 163-169. 20. Fritzen-Garcia et al., Sensors and Actuators B: Chemical, 182 (2013) 264-272 21. Hooda, P.V. International Journal of Biological Macromolecules, 106 (2018) 1173-1183. 22. Migliardini F, De Luca V, Carginale V, Rossi M, Corbo P, Supuran CT, Capasso C. Journal of Enzyme Inhibition and Medicinal Chemistry, 29 (2014) 146–150.
 Prof. Dr. Burhan Ateş
Prof. Dr. Burhan Ateş
İnönü Üniversitesi Fen Edebiyat Fakültesi
Kimya Bölümü
Gamze Dik
İnönü Üniversitesi Fen Edebiyat Fakültesi
Kimya Bölümü
Ahmet Ulu
İnönü Üniversitesi Fen Edebiyat Fakültesi
Kimya Bölümü

 Şekil 1. Yenilenebilir kaynaklar kullanılarak biyotemelli poliüretan malzemelerin sentezi (5)[/caption]
Kapsamlı bir yapı ve nitelikleri bakımından çeşitliliğe sahip poliüretanlar günümüzde bilinen biyouyumluluğu yüksek malzemelerden biridir. Çalışma yelpazesinin de geniş olmasıyla beraber, malzemeyle alakalı kritik noktalar vardır (6).
Vücutta toksik etkilere neden olabilecek çözücü, monomerler, zincir genişleticiler veya diğer kimyasallar olmamalıdır. Dayanıklılık, elastikiyet, elastomer benzeri karakter, yorulma direnci, uyum ve iyileşme sırasında biyouyumluluk gibi özellikler bulundurmalıdır (7, 8). Bu özelliklerin birçoğunu taşıyan poliüretanlar, doku mühendisliği, yara örtü malzemeleri, kardiyovasküler tedavi, ilaç taşıyıcı sistemler ve enzim immobilizasyonu gibi çeşitli biyomedikal alanlarda kullanılmaktadırlar (9).
Şekil 1. Yenilenebilir kaynaklar kullanılarak biyotemelli poliüretan malzemelerin sentezi (5)[/caption]
Kapsamlı bir yapı ve nitelikleri bakımından çeşitliliğe sahip poliüretanlar günümüzde bilinen biyouyumluluğu yüksek malzemelerden biridir. Çalışma yelpazesinin de geniş olmasıyla beraber, malzemeyle alakalı kritik noktalar vardır (6).
Vücutta toksik etkilere neden olabilecek çözücü, monomerler, zincir genişleticiler veya diğer kimyasallar olmamalıdır. Dayanıklılık, elastikiyet, elastomer benzeri karakter, yorulma direnci, uyum ve iyileşme sırasında biyouyumluluk gibi özellikler bulundurmalıdır (7, 8). Bu özelliklerin birçoğunu taşıyan poliüretanlar, doku mühendisliği, yara örtü malzemeleri, kardiyovasküler tedavi, ilaç taşıyıcı sistemler ve enzim immobilizasyonu gibi çeşitli biyomedikal alanlarda kullanılmaktadırlar (9).
 Şekil 2. Lakkaz immobilize edilen Fe (III)-PU/AOPAN/β-CD nanofiber membranın hazırlanması için ayrıntılı prosedürü gösteren şematik gösterim (14)[/caption]
Çeşitli deneylerden sonra elde edilen sonuçlar lakkaz enziminin nanofiber membran üzerine başarılı bir şekilde immobilize edildiğini göstermektedir. Lakkazın immobilizasyon miktarı 186,34 mg/g gibi yüksek bir değere ulaşmış ve mükemmel katalitik aktivite sergilemiştir. Ayrıca immobilize lakkaz serbest lakkaza oranla sıcaklık ve pH gibi parametrelerdeki değişikliklere karşı önemli ölçüde direnç göstermiştir. Enzim immobilizasyonu için kullanılan diğer taşıyıcılarla kıyaslandığında, PU/AOPAN/β-CD nanofiber membranın çok daha yüksek mekanik özelliklere, morfolojik stabiliteye ve rejenerasyon kapasitesine sahip olduğu gözlenmiştir. Bu sonuçlar göz önüne alındığında PU/AOPAN/β-CD karışımı nanofiber membranın enzimlerin immobilizasyonu için yenilikçi ve yüksek performanslı bir taşıyıcı destek malzemesi olduğunu söyleyebiliriz (14).
Bresolin ve arkadaşları yapmış oldukları çalışmada ise yeşil sentez yöntemiyle hazırlamış oldukları poliüretan köpüklere (PUF) lipaz enzimini immobilize etmeyi hedeflemişlerdir. İlk olarak hint yağı ve gliserol arasında enzimatik gliseroliz yoluyla PUF elde etmişlerdir. Daha sonrasında lipazın immobilizasyonu için destek materyali olarak kullanmışlardır. İmmobilizasyon verimi yaklaşık %94 olarak bulunmuştur. İmmmobilize edilmiş olan lipaz ve serbest lipaz farklı çözücülerde (metanol, etanol, propanol), pH değerlerinde, sıcaklıklarda ve çeşitli iyonların (Na+, Mg2+, Ca2+) varlığında test edilmiştir. Farklı pH koşullarında serbest lipaz aktivitesinin %80’nini kaybederken immobilize lipaz %22’sini kaybetmiştir. Yüksek sıcaklık koşullarında ise serbest enzim aktivitesinin %50’sini kaybederken immobilize lipaz aktivitesinin %95’ini korumuştur. Bunlara ek olarak çözücülerin varlığında serbest lipaz, metanol ve etanole karşı daha toleranslı iken immobilize lipaz propanole karşı daha toleranslı olduğu gösterilmiştir.
[caption id="attachment_105155" align="aligncenter" width="708"]
Şekil 2. Lakkaz immobilize edilen Fe (III)-PU/AOPAN/β-CD nanofiber membranın hazırlanması için ayrıntılı prosedürü gösteren şematik gösterim (14)[/caption]
Çeşitli deneylerden sonra elde edilen sonuçlar lakkaz enziminin nanofiber membran üzerine başarılı bir şekilde immobilize edildiğini göstermektedir. Lakkazın immobilizasyon miktarı 186,34 mg/g gibi yüksek bir değere ulaşmış ve mükemmel katalitik aktivite sergilemiştir. Ayrıca immobilize lakkaz serbest lakkaza oranla sıcaklık ve pH gibi parametrelerdeki değişikliklere karşı önemli ölçüde direnç göstermiştir. Enzim immobilizasyonu için kullanılan diğer taşıyıcılarla kıyaslandığında, PU/AOPAN/β-CD nanofiber membranın çok daha yüksek mekanik özelliklere, morfolojik stabiliteye ve rejenerasyon kapasitesine sahip olduğu gözlenmiştir. Bu sonuçlar göz önüne alındığında PU/AOPAN/β-CD karışımı nanofiber membranın enzimlerin immobilizasyonu için yenilikçi ve yüksek performanslı bir taşıyıcı destek malzemesi olduğunu söyleyebiliriz (14).
Bresolin ve arkadaşları yapmış oldukları çalışmada ise yeşil sentez yöntemiyle hazırlamış oldukları poliüretan köpüklere (PUF) lipaz enzimini immobilize etmeyi hedeflemişlerdir. İlk olarak hint yağı ve gliserol arasında enzimatik gliseroliz yoluyla PUF elde etmişlerdir. Daha sonrasında lipazın immobilizasyonu için destek materyali olarak kullanmışlardır. İmmobilizasyon verimi yaklaşık %94 olarak bulunmuştur. İmmmobilize edilmiş olan lipaz ve serbest lipaz farklı çözücülerde (metanol, etanol, propanol), pH değerlerinde, sıcaklıklarda ve çeşitli iyonların (Na+, Mg2+, Ca2+) varlığında test edilmiştir. Farklı pH koşullarında serbest lipaz aktivitesinin %80’nini kaybederken immobilize lipaz %22’sini kaybetmiştir. Yüksek sıcaklık koşullarında ise serbest enzim aktivitesinin %50’sini kaybederken immobilize lipaz aktivitesinin %95’ini korumuştur. Bunlara ek olarak çözücülerin varlığında serbest lipaz, metanol ve etanole karşı daha toleranslı iken immobilize lipaz propanole karşı daha toleranslı olduğu gösterilmiştir.
[caption id="attachment_105155" align="aligncenter" width="708"] Şekil 3. Sentezlenen poliüretan malzemelerin şematik gösterimi (16)[/caption]
Yapılan deneyler sonucunda immobilize lipaz 25 günlük depolamadan sonra bile başlangıç aktivitesinin %95,298.6’sını korumuştur. Ayrıca en iyi sonuçlar %90 immobilizasyon verimi ve maltogenaz adsopsiyon yöntemi ile AuNP’lerinde sağlanmıştır. Bunlara ek olarak AuNP’ler Ag-NP’lere oranla kümelenmeye daha az katılım göstermişlerdir. Tüm bunlar göz ününe alındığında PU metal konjugatlarının enzim immobilizasyonu için elverişli bir materyal olduğu düşünülebilir (16).
Cui ve arkadaşları lipazı farklı modifikasyonlarla PUF üzerinde immobilize etmek için etkili bir yöntem geliştirmişlerdir. İlk olarak PUF yüzeyindeki aktif grupları açığa çıkarmak için HCl ile muamele edilmiştir ve PUF–HCl üzerinde immobilize edilen lipazın PUF’a oranla daha yüksek aktivite sergilediği gözlenmiştir. Daha sonra PUF-HCl, AA/Polietilenimin (PEI) ile modifiye edilmiştir. PEI birincil, ikincil ve üçüncül amino grupları içeren geniş bir aralıktaki koşullar altında güçlü bir anyon değişim kapasitesine sahip ve bir enzim veya destek üzerindeki farklı parçalarla reaksiyona girme yeteneğine sahip bir polimerdir. Lipazın izoelektronik noktası pH 5.4‘te olduğundan PUF-HCl-AA/PEI ile kolaylıkla immobilize edilmiştir. Yapılan işlemler Şekil 4’te gösterilmektedir.
Şekil 3. Sentezlenen poliüretan malzemelerin şematik gösterimi (16)[/caption]
Yapılan deneyler sonucunda immobilize lipaz 25 günlük depolamadan sonra bile başlangıç aktivitesinin %95,298.6’sını korumuştur. Ayrıca en iyi sonuçlar %90 immobilizasyon verimi ve maltogenaz adsopsiyon yöntemi ile AuNP’lerinde sağlanmıştır. Bunlara ek olarak AuNP’ler Ag-NP’lere oranla kümelenmeye daha az katılım göstermişlerdir. Tüm bunlar göz ününe alındığında PU metal konjugatlarının enzim immobilizasyonu için elverişli bir materyal olduğu düşünülebilir (16).
Cui ve arkadaşları lipazı farklı modifikasyonlarla PUF üzerinde immobilize etmek için etkili bir yöntem geliştirmişlerdir. İlk olarak PUF yüzeyindeki aktif grupları açığa çıkarmak için HCl ile muamele edilmiştir ve PUF–HCl üzerinde immobilize edilen lipazın PUF’a oranla daha yüksek aktivite sergilediği gözlenmiştir. Daha sonra PUF-HCl, AA/Polietilenimin (PEI) ile modifiye edilmiştir. PEI birincil, ikincil ve üçüncül amino grupları içeren geniş bir aralıktaki koşullar altında güçlü bir anyon değişim kapasitesine sahip ve bir enzim veya destek üzerindeki farklı parçalarla reaksiyona girme yeteneğine sahip bir polimerdir. Lipazın izoelektronik noktası pH 5.4‘te olduğundan PUF-HCl-AA/PEI ile kolaylıkla immobilize edilmiştir. Yapılan işlemler Şekil 4’te gösterilmektedir.
 Elde edilen sonuçlara göre en yüksek aktivite PUF-HClAA/PEI’ da gözlenmiştir. PUF-HCl -AA/PEI’da gözlenen aktivite başlangıçtaki oran 2,41 katı olarak bulunmuştur. Son olarak immobilize edilmiş lipaz, A vitamini palmitatın sentezi için kullanılmıştır. İmmobilize lipazın 3L’lik bir biyoreaktörde 12 saat boyunca %90’ın üzerinde bir dönüşüm oranıyla 18 defaya kadar kullanılabildiği gözlemlenmiştir.
Sonuç olarak bu çalışma orta dereceli bir poliüretan mikro ortamının, immobilize lipaz aktivitesini ve stabilitesini artırmak için önemli olduğunu göstermektedir (17).
Facin ve arkadaşları yapmış oldukları çalışmada PUF üzerinde Thermomyces lanuginosus lipaz immobilizasyonunun farklı yöntemleri araştırılmıştır.
PU polimer, monomer olarak polieter ve toluen diizosiyanat kullanılarak sentezlenmiş ve lipaz immobilize edilmiştir. İmmobilizasyon işleminden önce ve sonra PU matrisi, çeşitli yöntemlerle karakterize edilmiştir. İmmobilize enzim 24 saat boyunca pH (7 ve 9), sıcaklık (24, 50 ve 60oC) aralığında stabilite ve 30 gün boyunca %80 aktivitesini koruyarak depolama kararlılığı sergilemiştir. Bu çalışmadan elde edilen sonuçlar immobilizasyon verimi açısından en iyi sonuçların yakalama yöntemi ve ligant ajanı olarak dopamin kullanılarak kovalent bağlama ile elde edilmiştir.
Hem serbest hem de immobilize enzim için benzer Vmax ve Km sonuçları immobilizasyon işleminin enzim affinitesini etkilemediğini göstermiştir. Ayrıca sıcaklık pH çözücü ve depolama stabilitesi ile ilgili olarak, PU temelli destekte immobilize edilmiş lipazın serbest enzime benzer sonuçlar verdiği gözlenmiştir. Soya fasulyesi yağı hidrolizinde immobilize enzimin uygulanması ve kullanılması, beş yeniden kullanım döngüsüne izin vermiştir. Bu nedenle PU sıcaklık ve pH’a karşı enzim özelliklerini iyileştirmemesine rağmen, immobilizasyon için düşük maliyetli bir matris olarak düşünülebilir (18).
Cipolatti ve arkadaşları yapmış oldukları çalışmada PU polietilen glikol (PEG) ile mini emülsiyon polimerizasyonunu kullanarak sentezlemiş ve enzim immobilizasyonu için bir destek materyali olarak sunmuşlardır. Enzim destek materyali olarak kullanılmasında molar ağırlığının ve PEG konsantrasyonunun etkisini incelemek için üç farklı molekül ağırlığına sahip PEG (400, 4000 ve 6000 Da) kullanılmıştır.
Daha sonra Thermomyces Lanuginosus lipazı (TLL) immobilize edilmiştir. TLL-PU-PEG6000 immobilize sistem yüksek katalitik sonuçlar göstermiştir. 50ºC’de ve daha geniş bir pH aralığında stabilite göstermiş ve yüksek bir etil ester üretimine yol açmıştır. Enzim immobilizasyonu ve PEG’in molekül kütlesi arasındaki ilişki Tablo 1’de gösterilmektedir.
Elde edilen sonuçlara göre en yüksek aktivite PUF-HClAA/PEI’ da gözlenmiştir. PUF-HCl -AA/PEI’da gözlenen aktivite başlangıçtaki oran 2,41 katı olarak bulunmuştur. Son olarak immobilize edilmiş lipaz, A vitamini palmitatın sentezi için kullanılmıştır. İmmobilize lipazın 3L’lik bir biyoreaktörde 12 saat boyunca %90’ın üzerinde bir dönüşüm oranıyla 18 defaya kadar kullanılabildiği gözlemlenmiştir.
Sonuç olarak bu çalışma orta dereceli bir poliüretan mikro ortamının, immobilize lipaz aktivitesini ve stabilitesini artırmak için önemli olduğunu göstermektedir (17).
Facin ve arkadaşları yapmış oldukları çalışmada PUF üzerinde Thermomyces lanuginosus lipaz immobilizasyonunun farklı yöntemleri araştırılmıştır.
PU polimer, monomer olarak polieter ve toluen diizosiyanat kullanılarak sentezlenmiş ve lipaz immobilize edilmiştir. İmmobilizasyon işleminden önce ve sonra PU matrisi, çeşitli yöntemlerle karakterize edilmiştir. İmmobilize enzim 24 saat boyunca pH (7 ve 9), sıcaklık (24, 50 ve 60oC) aralığında stabilite ve 30 gün boyunca %80 aktivitesini koruyarak depolama kararlılığı sergilemiştir. Bu çalışmadan elde edilen sonuçlar immobilizasyon verimi açısından en iyi sonuçların yakalama yöntemi ve ligant ajanı olarak dopamin kullanılarak kovalent bağlama ile elde edilmiştir.
Hem serbest hem de immobilize enzim için benzer Vmax ve Km sonuçları immobilizasyon işleminin enzim affinitesini etkilemediğini göstermiştir. Ayrıca sıcaklık pH çözücü ve depolama stabilitesi ile ilgili olarak, PU temelli destekte immobilize edilmiş lipazın serbest enzime benzer sonuçlar verdiği gözlenmiştir. Soya fasulyesi yağı hidrolizinde immobilize enzimin uygulanması ve kullanılması, beş yeniden kullanım döngüsüne izin vermiştir. Bu nedenle PU sıcaklık ve pH’a karşı enzim özelliklerini iyileştirmemesine rağmen, immobilizasyon için düşük maliyetli bir matris olarak düşünülebilir (18).
Cipolatti ve arkadaşları yapmış oldukları çalışmada PU polietilen glikol (PEG) ile mini emülsiyon polimerizasyonunu kullanarak sentezlemiş ve enzim immobilizasyonu için bir destek materyali olarak sunmuşlardır. Enzim destek materyali olarak kullanılmasında molar ağırlığının ve PEG konsantrasyonunun etkisini incelemek için üç farklı molekül ağırlığına sahip PEG (400, 4000 ve 6000 Da) kullanılmıştır.
Daha sonra Thermomyces Lanuginosus lipazı (TLL) immobilize edilmiştir. TLL-PU-PEG6000 immobilize sistem yüksek katalitik sonuçlar göstermiştir. 50ºC’de ve daha geniş bir pH aralığında stabilite göstermiş ve yüksek bir etil ester üretimine yol açmıştır. Enzim immobilizasyonu ve PEG’in molekül kütlesi arasındaki ilişki Tablo 1’de gösterilmektedir.
 Sonuç olarak TLL-PU-PEG 6000’in etil ester üretiminde en yüksek değerlere sahip olduğundan, çözücüsüz sistemlerde etanoliz reaksiyonları için potansiyel bir düşük maliyetli katalizör olduğunu söyleyebiliriz (19). Creczynski-Pasa ve arkadaşları yapmış oldukları çalışmada PEG NPs ile fonksiyonelleştirerek saflaştırılmış yaban turpu peroksidazı (HRP) immobilize etmişlerdir. İmmobilizasyon işleminin katalitik aktivitesi üzerindeki etkisi ve işlem morfolojik analizler ile değerlendirildi. HRP’nin PU-PEG NPs üzerinde immobilizasyon işlemi, beklendiği gibi enzimin yeniden kullanılabilirliğini artırdı. Ayrıca 50 günlük depolamadan sonra orijinal aktivitenin %50’sini korunduğu gözlendi. Şekil 5 PU-PEG’e immobilize edilen HRP’nin şematik gösterimidir.
Sonuç olarak TLL-PU-PEG 6000’in etil ester üretiminde en yüksek değerlere sahip olduğundan, çözücüsüz sistemlerde etanoliz reaksiyonları için potansiyel bir düşük maliyetli katalizör olduğunu söyleyebiliriz (19). Creczynski-Pasa ve arkadaşları yapmış oldukları çalışmada PEG NPs ile fonksiyonelleştirerek saflaştırılmış yaban turpu peroksidazı (HRP) immobilize etmişlerdir. İmmobilizasyon işleminin katalitik aktivitesi üzerindeki etkisi ve işlem morfolojik analizler ile değerlendirildi. HRP’nin PU-PEG NPs üzerinde immobilizasyon işlemi, beklendiği gibi enzimin yeniden kullanılabilirliğini artırdı. Ayrıca 50 günlük depolamadan sonra orijinal aktivitenin %50’sini korunduğu gözlendi. Şekil 5 PU-PEG’e immobilize edilen HRP’nin şematik gösterimidir.
 Bu çalışmada geliştirilen modifiye karbon elektrotile dopamin geri kazanımı %97 ile %107 arasına olup, yaklaşık 2 dakikalık toplam test süresi, hazırlanmasının kolaylığı ve 400 tayine kadar kullanılabilirliği açısından büyük önem taşır.
Son olarak PU-PEG NPs’lerin enzim immobilizasyonu için uygun bir materyal olduğunu ve de dopamin tayinin düşük limitlerde bile tespiti için karbon elektrodun kullanımının son derece avantajlı olduğunu söyleyebiliriz (20).
Hooda ve arkadaşları yapmış oldukları çalışmada Vigna mungo’dan saflaştırılmış kitinaz ve Canavalia ensiformis’ten saflaştırılmış N-asetil B-glukoaminidaz’ı, PU/çinko oksit NPs kompozit matriks üzerinde sırasıyla 0.785 ve 96.19’luk bir konjugasyon verimi ve spesifik aktivitenin tutulmasıyla immobilize etmişlerdir.
Yapısal ve morfolojik analizler PU matris üzerinde ZnO NPs’nin ve enzimlerin varlığını doğrulamıştır. Sentezlenen PU/ZnO/Kitinaz/NAGase konjugatının optimum sıcaklık, pH ve substrat konstarasyonları belirlenerek buğday tanelerinde kitin tayini için, optik bir biyosensör olarak kullanılmıştır. Saptama sınırı, 0.1 ila 10 mM doğrusallık ile 0.01 mM olarak bulunmuştur. Eklenen kitinin geri kazanım yüzdesi yaklaşık olarak %95 ile %96,5 arasında olarak bulunmuştur.
Bu yöntem 3,5-dinitrosalisilik asit yöntemi ile iyi bir korelasyon göstermiştir. PU/ZnO/kitinaz/NAGaz, iyi termal ve stok stabiliteleri göstermiş ve kayda değer bir aktivite kaybı olmadan 10 kez yeniden kullanılabilir olduğu tespit edilmiştir.
[caption id="attachment_105159" align="aligncenter" width="657"]
Bu çalışmada geliştirilen modifiye karbon elektrotile dopamin geri kazanımı %97 ile %107 arasına olup, yaklaşık 2 dakikalık toplam test süresi, hazırlanmasının kolaylığı ve 400 tayine kadar kullanılabilirliği açısından büyük önem taşır.
Son olarak PU-PEG NPs’lerin enzim immobilizasyonu için uygun bir materyal olduğunu ve de dopamin tayinin düşük limitlerde bile tespiti için karbon elektrodun kullanımının son derece avantajlı olduğunu söyleyebiliriz (20).
Hooda ve arkadaşları yapmış oldukları çalışmada Vigna mungo’dan saflaştırılmış kitinaz ve Canavalia ensiformis’ten saflaştırılmış N-asetil B-glukoaminidaz’ı, PU/çinko oksit NPs kompozit matriks üzerinde sırasıyla 0.785 ve 96.19’luk bir konjugasyon verimi ve spesifik aktivitenin tutulmasıyla immobilize etmişlerdir.
Yapısal ve morfolojik analizler PU matris üzerinde ZnO NPs’nin ve enzimlerin varlığını doğrulamıştır. Sentezlenen PU/ZnO/Kitinaz/NAGase konjugatının optimum sıcaklık, pH ve substrat konstarasyonları belirlenerek buğday tanelerinde kitin tayini için, optik bir biyosensör olarak kullanılmıştır. Saptama sınırı, 0.1 ila 10 mM doğrusallık ile 0.01 mM olarak bulunmuştur. Eklenen kitinin geri kazanım yüzdesi yaklaşık olarak %95 ile %96,5 arasında olarak bulunmuştur.
Bu yöntem 3,5-dinitrosalisilik asit yöntemi ile iyi bir korelasyon göstermiştir. PU/ZnO/kitinaz/NAGaz, iyi termal ve stok stabiliteleri göstermiş ve kayda değer bir aktivite kaybı olmadan 10 kez yeniden kullanılabilir olduğu tespit edilmiştir.
[caption id="attachment_105159" align="aligncenter" width="657"] Şekil 6. Kitinaz/NAGaz’ın PU/nano ZnO kompozit üzerinde birlikte immobilizasyonu. PU üretan grupları ile enzimin amin ve/veya hidroksil grupları arasındaki reaksiyon kutuda gösterilmektedir (21)[/caption]
Özetleyecek olursak, iki kitinolitik enzim kitinaz ve NAGaz, PU/ZnO nano hibrit desteği üzerinde birlikte immobilize edilmiştir ve depolanan buğday tanelerinde kitin içeriklerinin belirlenmesi için absorpsiyon bazlı optik biyosensör geliştirmek ve emmek için kullanılmıştır. Aktivite için daha geniş pH ve sıcaklık aralığı, kinetik parametreler için kabul edilebilir değerler ve PU/ZnO/Kitinaz/NAGaz konjugatlarının serbest enzimlerle eşleştirilmiş olarak geliştirilmiş termal ve depolama kararlılıkları da desteğin uygunluğunu doğrulanmıştır. Konjugatların depolanmış buğday irmiklerinde kitini algılama etkinliği, analitik geri kazanım, varyasyon katsayısı ve belirleme katsayısı için tespit sınırındaki ve kabul edilebilir değerlerdeki önemli iyileştirmelerle kanıtlanmıştır. Genel olarak, kitin tayini için sonuçlar tutarlı, güvenilir ve tekrarlanabilirdi. Bu yöntemin herhangi bir karmaşık araç kullanmadan ve rutin temelde tahılların ürünlerinin kalitesini kontrol etmek için uygun şekilde kullanılabileceğini söyleyebiliriz (21).
Migliardini ve arkadaşları yaptıkları çalışmada biyomimetik yaklaşımdan yola çıkarak, PUF’a Karbonik anhidraz (CA, EC 4.2.1.1) immobilize edip, ilginç bir CO2 yaklaşım, CO2 yakalama stratejisi geliştirmişlerdir. Biyomimetik ’i metabolik yollardan veya Karbonik Anhidraz gibi bir enzim kullanarak sabitleyen mikroorganizmaları kullanır. Yapmış olan çalışmada kullanılan SspCA adlı CA enzimi Sulfurihydrogenibium yellowstonense’den saflaştırılmıştır. SspCA bir PUF üzerine immobilize edilerek, bir enerji santrali uygulamasına yakın koşullarda CO2 tutma kapasitesini doğrulamayı amaçlayan deneysel testler için PU-SspCA içeren bir biyoreaktör kullanıldı.
Bu biyoreaktörde, CO2 içeren bir gaz fazı, gaz fazında bulunan CO2’in absorbe edildiği ve CA tarafından verimli bir şekilde bikarbonata dönüştürüldüğü koşullar altında bir sıvı faz ile temas ettirilmiştir. PUF üzerine immobilize edilen enzimin 100ºC aktivitesini koruyarak ve 50 saate kadar stabil olduğu gözlenmiştir. Ayrıca oda sıcaklığında 1 ay boyunca kararlığını korumuştur. Bunlara ek olarak PU-SspCA makalede bildirilen biyoreaktörde kullanıldığında iyi bir CO2 yakalama performansı göstermiştir. Bu sonuçlar göz önüne alınırsa termostabil PU-SspCA’ın biyomimetik yaklaşımla CO2 idrasyonu için güçlü bir aday olduğunu göstermektedir. (22)
Şekil 6. Kitinaz/NAGaz’ın PU/nano ZnO kompozit üzerinde birlikte immobilizasyonu. PU üretan grupları ile enzimin amin ve/veya hidroksil grupları arasındaki reaksiyon kutuda gösterilmektedir (21)[/caption]
Özetleyecek olursak, iki kitinolitik enzim kitinaz ve NAGaz, PU/ZnO nano hibrit desteği üzerinde birlikte immobilize edilmiştir ve depolanan buğday tanelerinde kitin içeriklerinin belirlenmesi için absorpsiyon bazlı optik biyosensör geliştirmek ve emmek için kullanılmıştır. Aktivite için daha geniş pH ve sıcaklık aralığı, kinetik parametreler için kabul edilebilir değerler ve PU/ZnO/Kitinaz/NAGaz konjugatlarının serbest enzimlerle eşleştirilmiş olarak geliştirilmiş termal ve depolama kararlılıkları da desteğin uygunluğunu doğrulanmıştır. Konjugatların depolanmış buğday irmiklerinde kitini algılama etkinliği, analitik geri kazanım, varyasyon katsayısı ve belirleme katsayısı için tespit sınırındaki ve kabul edilebilir değerlerdeki önemli iyileştirmelerle kanıtlanmıştır. Genel olarak, kitin tayini için sonuçlar tutarlı, güvenilir ve tekrarlanabilirdi. Bu yöntemin herhangi bir karmaşık araç kullanmadan ve rutin temelde tahılların ürünlerinin kalitesini kontrol etmek için uygun şekilde kullanılabileceğini söyleyebiliriz (21).
Migliardini ve arkadaşları yaptıkları çalışmada biyomimetik yaklaşımdan yola çıkarak, PUF’a Karbonik anhidraz (CA, EC 4.2.1.1) immobilize edip, ilginç bir CO2 yaklaşım, CO2 yakalama stratejisi geliştirmişlerdir. Biyomimetik ’i metabolik yollardan veya Karbonik Anhidraz gibi bir enzim kullanarak sabitleyen mikroorganizmaları kullanır. Yapmış olan çalışmada kullanılan SspCA adlı CA enzimi Sulfurihydrogenibium yellowstonense’den saflaştırılmıştır. SspCA bir PUF üzerine immobilize edilerek, bir enerji santrali uygulamasına yakın koşullarda CO2 tutma kapasitesini doğrulamayı amaçlayan deneysel testler için PU-SspCA içeren bir biyoreaktör kullanıldı.
Bu biyoreaktörde, CO2 içeren bir gaz fazı, gaz fazında bulunan CO2’in absorbe edildiği ve CA tarafından verimli bir şekilde bikarbonata dönüştürüldüğü koşullar altında bir sıvı faz ile temas ettirilmiştir. PUF üzerine immobilize edilen enzimin 100ºC aktivitesini koruyarak ve 50 saate kadar stabil olduğu gözlenmiştir. Ayrıca oda sıcaklığında 1 ay boyunca kararlığını korumuştur. Bunlara ek olarak PU-SspCA makalede bildirilen biyoreaktörde kullanıldığında iyi bir CO2 yakalama performansı göstermiştir. Bu sonuçlar göz önüne alınırsa termostabil PU-SspCA’ın biyomimetik yaklaşımla CO2 idrasyonu için güçlü bir aday olduğunu göstermektedir. (22)
 Prof. Dr. Burhan Ateş
İnönü Üniversitesi Fen Edebiyat Fakültesi
Kimya Bölümü
Gamze Dik
İnönü Üniversitesi Fen Edebiyat Fakültesi
Kimya Bölümü
Ahmet Ulu
İnönü Üniversitesi Fen Edebiyat Fakültesi
Kimya Bölümü
Prof. Dr. Burhan Ateş
İnönü Üniversitesi Fen Edebiyat Fakültesi
Kimya Bölümü
Gamze Dik
İnönü Üniversitesi Fen Edebiyat Fakültesi
Kimya Bölümü
Ahmet Ulu
İnönü Üniversitesi Fen Edebiyat Fakültesi
Kimya Bölümü