 Hillebrand Chemicals Kimyasal Pazarlama Ltd. Şti. Genel Müdürü İzzet Aydın, elektrokaplama konusunu detaylarıyla anlattı.
Hillebrand Chemicals Kimyasal Pazarlama Ltd. Şti. Genel Müdürü İzzet Aydın, elektrokaplama konusunu detaylarıyla anlattı.
Katman Oluşumunun Atomistik Görünümü
Sulu elektrolitlerden metalik tabakaların biriktirilmesi, elektrolit çözeltisinde bulunan metal iyonlarının katoda (alt tabaka, baz, iş parçası, ürün, bileşen) ulaşması, katot/elektrolit ara yüzeyinde elektron absorpsiyonu ile boşaltılması ve katot yüzeyinde metal
atomları olarak depolanır. Metal iyonlarını boşaltmak için gereken elektronlar ya harici bir voltaj kaynağından (elektrokimyasal metal çökeltme) alınır ya da elektrolite eklenen indirgeyici bir madde (kimyasal metal çökeltme) ile sağlanır. Metal iyonlarını boşaltmak için gereken elektronlar ya harici bir voltaj kaynağından (elektrokimyasal metal çökeltme) alınır ya da elektrolite eklenen indirgeyici bir madde (kimyasal metal çökeltme) ile sağlanır. Elektrokimyasal metal biriktirme süreci, Şekil 1’de özetlenmiştir.

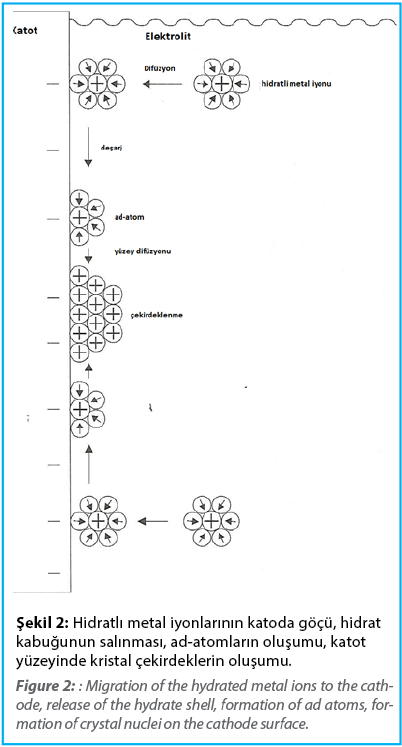
Bununla birlikte, metal biriktirme süreci gerçekte çok daha karmaşıktır ve birkaç alt aşamayı içerir. Bu alt aşamaların en önemlileri:
• Hidratlı metal iyonlarının veya komplekslerinin elektrolit çözeltisinin içinden katoda aktarılması.
• Katot/elektrolit arayüzünde metal iyonlarının hidrasyon kabuğunun soyulması.
• Katot yüzeyinde yük değişimi ve adsorbe edilmiş atomların (ad-atomları) oluşumu.
• Katot yüzeyinde ad atomlarının yüzey difüzyonu ile kristal çekirdeklerin oluşumu.
•
Metalik bir tabaka oluşturmak için termodinamik olarak kararlı kristal çekirdeklerin büyümesi.
Bu kısmi adımlar Şekil 2’de özetlenmiştir. Bu gösterimin aynı zamanda gerçek koşulları oldukça basitleştirilmiş bir şekilde yansıttığını hatırlamak önemlidir. Metal iyonlarının elektrolit çözeltisinin içinden katoda taşınması esas olarak konveksiyon ve difüzyon ile gerçekleşir. Ad atomlarının güç aktarımı ile boşalması, katot/elektrolit ara yüzeyi boyunca kendiliğinden oluşan elektrolitik çift katmanda gerçekleşir. Bununla birlikte, işlemde, metal iyonları yüklerini tamamen kaybetmezler, ancak belirli bir artık yükü ve dolayısıyla hidrat kabuğunun bir parçasını korurlar. Elektrolitik çift tabakadan geçirildikten sonra bu halde katot yüzeyinde adsorbe edilirler ve orada ad-atomlar oluştururlar. Katmanın oluşumu şimdi, çekirdeklenme ve kristal büyümesi olarak adlandırılan iki birleşik süreç daha gerektirir. Çekirdeklenme, katot yüzeyindeki reklam atomlarının difüzyon kontrollü kombinasyonu yoluyla gerçekleşir. Büyüme süreci, elde edilen kristal çekirdekler kritik bir boyuta ulaştığı anda başlar.
Metal İyon Yapısı
Biriktirme için metal iyonları elektrolit çözeltisinde nadiren bulunur veya basit bir yapıya sahip iyonlar şeklinde çok küçük miktarlarda bulunur. Kural olarak, diğer atomlar, moleküller veya iyonlarla, ancak özellikle su molekülleriyle çevrilidirler. İkinci durumda, Şekil 3’te şematik olarak gösterilen su molekülünün geometrik yapısı önemli bir rol oynamaktadır.
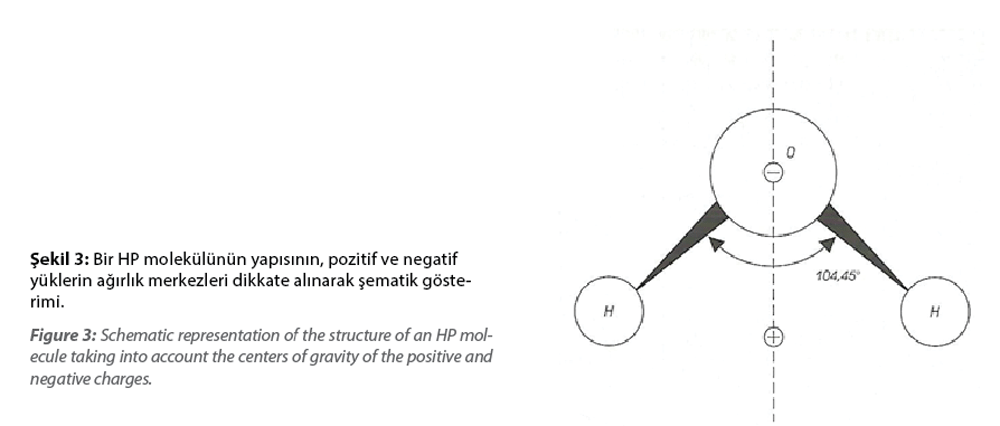
Hidrojen atomları arasında 104,450 değerinde bir valans açısının oluşması, su molekülünün güçlü dipol özelliklerinin nedenidir. Pozitif yüklü metal iyonları ve su molekülleri arasındaki elektrostatik çekim kuvveti, bir hidrat kabuğu tarafından korunan, solvatlı katyonlar olarak da adlandırılan hidratlı metal iyonlarının oluşumuna yol açar. Bunların bileşimi genel formülle sembolize edilebilir. MeZ+, z-değerli metal iyonunu (katyon) temsil ederken, x, metal iyonunu çevreleyen su moleküllerinin sayısını gösterir.
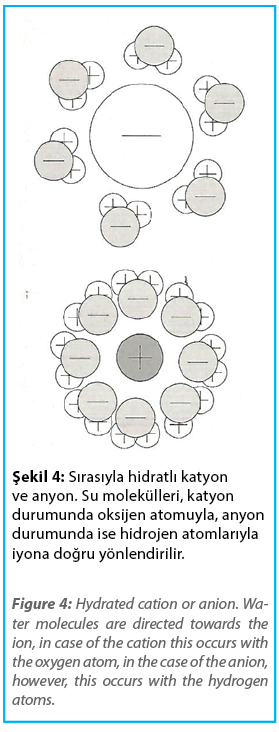
Şekil 4, hidratlı bir metal iyonunun yapısını şematik olarak göstermektedir. Hidratlanmış bir anyonun bileşimi de karşılaştırma için verilmiştir. Bu şekil, katyonların ve anyonların farklı çaplarından dolayı farklı hidrasyon davranışlarına sahip olduğunu, aynı zamanda su molekülünün “üçgen” yapısı ve polar karakteri nedeniyle göstermektedir. Pozitif yüklü katyonlarda oksijen atomları, negatif yüklü anyonlarda ise hidrojen atomları merkezi iyona dönüktür. Ayrıca, katyonlar durumunda hidrasyonun kapsamı, anyonlar durumundan daha fazladır. Bunun nedeni katyonların anyonlardan daha küçük iyon yarıçapına sahip olmasıdır.
Kaynakça / References
Elektrochemie I‘ Chemie Weinheim Verlag
Vom Ion zur Elektrode‘ VEW Deutscher Verlag
Zur Theorie der diffusion Doppelschicht‘ Zeitschrift für Elektrochemie
On the structure of charged interfaces‘ Proc. Roy. Soc.
Theory and Principle of Electrode Processes‘ The Ronald Press Company
Elektroorganische Chemie‘ Verlag Chemie Weinheim
İzzet Aydın
Genel Müdür
Hillebrand Chemicals Kimyasal Pazarlama Ltd. Şti.

 Hillebrand Chemicals Kimyasal Pazarlama Ltd. Şti. Genel Müdürü İzzet Aydın, elektrokaplama konusunu detaylarıyla anlattı.
Hillebrand Chemicals Kimyasal Pazarlama Ltd. Şti. Genel Müdürü İzzet Aydın, elektrokaplama konusunu detaylarıyla anlattı.
 Bununla birlikte, metal biriktirme süreci gerçekte çok daha karmaşıktır ve birkaç alt aşamayı içerir. Bu alt aşamaların en önemlileri:
• Hidratlı metal iyonlarının veya komplekslerinin elektrolit çözeltisinin içinden katoda aktarılması.
• Katot/elektrolit arayüzünde metal iyonlarının hidrasyon kabuğunun soyulması.
• Katot yüzeyinde yük değişimi ve adsorbe edilmiş atomların (ad-atomları) oluşumu.
• Katot yüzeyinde ad atomlarının yüzey difüzyonu ile kristal çekirdeklerin oluşumu.
• Metalik bir tabaka oluşturmak için termodinamik olarak kararlı kristal çekirdeklerin büyümesi.
Bu kısmi adımlar Şekil 2’de özetlenmiştir. Bu gösterimin aynı zamanda gerçek koşulları oldukça basitleştirilmiş bir şekilde yansıttığını hatırlamak önemlidir. Metal iyonlarının elektrolit çözeltisinin içinden katoda taşınması esas olarak konveksiyon ve difüzyon ile gerçekleşir. Ad atomlarının güç aktarımı ile boşalması, katot/elektrolit ara yüzeyi boyunca kendiliğinden oluşan elektrolitik çift katmanda gerçekleşir. Bununla birlikte, işlemde, metal iyonları yüklerini tamamen kaybetmezler, ancak belirli bir artık yükü ve dolayısıyla hidrat kabuğunun bir parçasını korurlar. Elektrolitik çift tabakadan geçirildikten sonra bu halde katot yüzeyinde adsorbe edilirler ve orada ad-atomlar oluştururlar. Katmanın oluşumu şimdi, çekirdeklenme ve kristal büyümesi olarak adlandırılan iki birleşik süreç daha gerektirir. Çekirdeklenme, katot yüzeyindeki reklam atomlarının difüzyon kontrollü kombinasyonu yoluyla gerçekleşir. Büyüme süreci, elde edilen kristal çekirdekler kritik bir boyuta ulaştığı anda başlar.
Bununla birlikte, metal biriktirme süreci gerçekte çok daha karmaşıktır ve birkaç alt aşamayı içerir. Bu alt aşamaların en önemlileri:
• Hidratlı metal iyonlarının veya komplekslerinin elektrolit çözeltisinin içinden katoda aktarılması.
• Katot/elektrolit arayüzünde metal iyonlarının hidrasyon kabuğunun soyulması.
• Katot yüzeyinde yük değişimi ve adsorbe edilmiş atomların (ad-atomları) oluşumu.
• Katot yüzeyinde ad atomlarının yüzey difüzyonu ile kristal çekirdeklerin oluşumu.
• Metalik bir tabaka oluşturmak için termodinamik olarak kararlı kristal çekirdeklerin büyümesi.
Bu kısmi adımlar Şekil 2’de özetlenmiştir. Bu gösterimin aynı zamanda gerçek koşulları oldukça basitleştirilmiş bir şekilde yansıttığını hatırlamak önemlidir. Metal iyonlarının elektrolit çözeltisinin içinden katoda taşınması esas olarak konveksiyon ve difüzyon ile gerçekleşir. Ad atomlarının güç aktarımı ile boşalması, katot/elektrolit ara yüzeyi boyunca kendiliğinden oluşan elektrolitik çift katmanda gerçekleşir. Bununla birlikte, işlemde, metal iyonları yüklerini tamamen kaybetmezler, ancak belirli bir artık yükü ve dolayısıyla hidrat kabuğunun bir parçasını korurlar. Elektrolitik çift tabakadan geçirildikten sonra bu halde katot yüzeyinde adsorbe edilirler ve orada ad-atomlar oluştururlar. Katmanın oluşumu şimdi, çekirdeklenme ve kristal büyümesi olarak adlandırılan iki birleşik süreç daha gerektirir. Çekirdeklenme, katot yüzeyindeki reklam atomlarının difüzyon kontrollü kombinasyonu yoluyla gerçekleşir. Büyüme süreci, elde edilen kristal çekirdekler kritik bir boyuta ulaştığı anda başlar.

 Hidrojen atomları arasında 104,450 değerinde bir valans açısının oluşması, su molekülünün güçlü dipol özelliklerinin nedenidir. Pozitif yüklü metal iyonları ve su molekülleri arasındaki elektrostatik çekim kuvveti, bir hidrat kabuğu tarafından korunan, solvatlı katyonlar olarak da adlandırılan hidratlı metal iyonlarının oluşumuna yol açar. Bunların bileşimi genel formülle sembolize edilebilir. MeZ+, z-değerli metal iyonunu (katyon) temsil ederken, x, metal iyonunu çevreleyen su moleküllerinin sayısını gösterir.
Şekil 4, hidratlı bir metal iyonunun yapısını şematik olarak göstermektedir. Hidratlanmış bir anyonun bileşimi de karşılaştırma için verilmiştir. Bu şekil, katyonların ve anyonların farklı çaplarından dolayı farklı hidrasyon davranışlarına sahip olduğunu, aynı zamanda su molekülünün “üçgen” yapısı ve polar karakteri nedeniyle göstermektedir. Pozitif yüklü katyonlarda oksijen atomları, negatif yüklü anyonlarda ise hidrojen atomları merkezi iyona dönüktür. Ayrıca, katyonlar durumunda hidrasyonun kapsamı, anyonlar durumundan daha fazladır. Bunun nedeni katyonların anyonlardan daha küçük iyon yarıçapına sahip olmasıdır.
Hidrojen atomları arasında 104,450 değerinde bir valans açısının oluşması, su molekülünün güçlü dipol özelliklerinin nedenidir. Pozitif yüklü metal iyonları ve su molekülleri arasındaki elektrostatik çekim kuvveti, bir hidrat kabuğu tarafından korunan, solvatlı katyonlar olarak da adlandırılan hidratlı metal iyonlarının oluşumuna yol açar. Bunların bileşimi genel formülle sembolize edilebilir. MeZ+, z-değerli metal iyonunu (katyon) temsil ederken, x, metal iyonunu çevreleyen su moleküllerinin sayısını gösterir.
Şekil 4, hidratlı bir metal iyonunun yapısını şematik olarak göstermektedir. Hidratlanmış bir anyonun bileşimi de karşılaştırma için verilmiştir. Bu şekil, katyonların ve anyonların farklı çaplarından dolayı farklı hidrasyon davranışlarına sahip olduğunu, aynı zamanda su molekülünün “üçgen” yapısı ve polar karakteri nedeniyle göstermektedir. Pozitif yüklü katyonlarda oksijen atomları, negatif yüklü anyonlarda ise hidrojen atomları merkezi iyona dönüktür. Ayrıca, katyonlar durumunda hidrasyonun kapsamı, anyonlar durumundan daha fazladır. Bunun nedeni katyonların anyonlardan daha küçük iyon yarıçapına sahip olmasıdır.
 Kaynakça / References
Elektrochemie I‘ Chemie Weinheim Verlag
Vom Ion zur Elektrode‘ VEW Deutscher Verlag
Zur Theorie der diffusion Doppelschicht‘ Zeitschrift für Elektrochemie
On the structure of charged interfaces‘ Proc. Roy. Soc.
Theory and Principle of Electrode Processes‘ The Ronald Press Company
Elektroorganische Chemie‘ Verlag Chemie Weinheim
İzzet Aydın
Genel Müdür
Hillebrand Chemicals Kimyasal Pazarlama Ltd. Şti.
Kaynakça / References
Elektrochemie I‘ Chemie Weinheim Verlag
Vom Ion zur Elektrode‘ VEW Deutscher Verlag
Zur Theorie der diffusion Doppelschicht‘ Zeitschrift für Elektrochemie
On the structure of charged interfaces‘ Proc. Roy. Soc.
Theory and Principle of Electrode Processes‘ The Ronald Press Company
Elektroorganische Chemie‘ Verlag Chemie Weinheim
İzzet Aydın
Genel Müdür
Hillebrand Chemicals Kimyasal Pazarlama Ltd. Şti.