Bitki Biyoaktif Bileşenlerinin Bitki Organ, Doku ve Hücre Kültürü Teknikleri İle Üretimi
Özet
Bitkilerin tozlaşma için böcekleri cezbetmek, zararlıları uzaklaştırmak ya da mikroorganizmalardan korunmak amaçlı ürettiği biyoaktif bileşenler çok sayıda farklı endüstri için önemli bileşenlerdir. Biyoaktif bileşiklerin bitkinin toplam kimyasal kompozisyonu içerisindeki miktarı toprak, çevre ya da bitkinin genotip özeliğine göre farklılık göstermektedir.
Bitki organ, doku ve hücre kültürü yöntemleri bitkilerin klonlandığı steril koşullarda gerçekleştirken kültür ortamı şartlarında kararlı oranlarda metabolit üretiminin gerçekleşmesi mümkündür. Bu çalışmada steril bitki çoğaltım şartlarında bitki metabolitlerinin üretimi açıklanmıştır.
Giriş
Primer metabolitler bitkilerin yaşamlarını sürdürmesi için elzem metebolitlerdir. İkincil metabolitler ise savunma, feromon, atık olarak depolama gibi ihtiyaçları için ürettikleri metabolitlerdir. Bu ürünler tıp ve kozmetik kullanım için de temel oluşturur. WHO’nun Temel İlaçlar Model Listesi’nde 210 küçük moleküllü ilaç hammaddesi bulunurken bunların
17’si bitki kökenlidir (Başer, 2012).
Bitkiler, polen taşıyan arıları cezbeden koku, predatörleri uzaklaştıran acı ya da zehirli tat ya da allelopati kimyasalları geliştirmiştir. Biyoaktif ürünler başka bir canlıyı cezbetmek için olması yanında kofulda biriktirmek suretiyle depo ettikleri hücreye zararlı olabilecek biyokimyasallar da olabilir.
Tüm bu fitokimyasal bileşiklerin gıda takviyesi, ağrı kesici, sakinleştirici, öksürük giderici gibi ilaçlarda, antioksidan, boyar madde olarak tekstil sanayisinde, böcek öldürücü ya da patojenlerle mücadele amaçlı tarımsal üretimde, aroma ve tat bileşenleri olarak gıda sanayisinde kullanımı mümkün olmuştur (Yu ve ark.2021).
Bitkisel metabolit verimi doğal koşullar altında kararsızdır ve üretim maliyetleri yüksektir (Chandran, 2020). Doku kültürü yöntemleriyle in vitro şartlardaki yoğun işgücü, düşük, stabil olmayan ürün verimi, yıl içerisinde mevsim şartlarına bağlı kalmadan standardize edilebilir. Biyoaktif bileşenlerin doku kültürü yöntemiyle in vitro şartlarda üretimi ile kimyasal kontaminasyon riski azalmaktadır.
Biyoaktif metabolit verimi organ, doku ve hücre kültürü yöntemleri kullanılarak önemli bir
seviyeye çıkar (Wawrosch ve Sergey, 2021).
Totipotensi ve Mikroçoğaltım
Bitkiler totipotensi özellikleri sayesinde farklılaşmış dokularından tekrar farklı organlar oluşturabilir. Totipotensi özelliği bitkilere vejetatif çoğalma yeteneği sağlar. Bu yöntem klonal çoğaltımı mümkün kılar (Feher, 2019). Doku kültürü yöntemi steril laboratuvar koşullarında vejejatif üretim yöntemine önemli bir örnektir.
Virüs ve diğer patojenlerden arındırılan steril şartlardaki yapay besi içerikleriyle
oluşturulan kaplarda organ, doku ya da hücrelerin çoğaltımı mümkün olur.
Doku kültürü yöntemleriyle yıl içerisinde on iki ay sürekli yeknesak üretim sağlar. Doku kültürü yöntemleri, hastalık etmenleri, istenmeyen kimyasal kontaminasyonlar, zararlı ve virüs enfeksiyonlarından ari kesintisiz bir üretim imkanı sağlar. İlk yatırım maliyeti, yetişmiş deneyimli işgücü ihtiyacı bu yöntemi zorlu kılan sebeplerdir. Bu durum bitki doku
kültürleri üzerine ihtisaslaşma alanı doğurmuştur.
Hektarlarca alanda tarımı yapılan ya da doğadan toplanan bitkinin hasat edilip işlenmesi yerine doku kültürü yöntemleriyle etken madde üretimi daha elverişlidir (Espinosa-Leal ve ark., 2018).
Doku kültürü yöntemi bitkilerin laboratuvar ortamında steril kaplar içerisindeki yapay aydınlatma ve iklimlendirme şartları altında çoğaltılmasıdır. Bu yöntem ile yıl boyu kesintisiz hastalıktan arındırılmış klonal üretim bitki imkanı sağlanır. İklim ve mevsim şartlarından bağımsız üretim şartların oluştuğu için aritmetik çoğaltım hızı sağlanmış olur.
Doku kültürü yöntemleri ekonomik değeri yüksek bitkilerin ticari çoğaltım yöntemi olduğu gibi ıslah, ex-situ koruma amacıyla bitkisel biyoaktif bileşenlerinin yoğun oranlarda çoğaltılabildiği bir yöntemdir.
Hücre süspansiyon kültürüleriyle biyoreaksiyon prosesleri takip edilerek biyoaktif ürünleri
üretilebilmektedir. Bu ürünler ilaç hammaddeleri olabildiği gibi, farmasötikler, bitki büyüme düzenleyicileri ve bitki hücreleri içerisinde üretilip ekonomiye kazandırılabilecek pek çok farklı ürün olabilir (Motolinía-Alcántara ve ark., 2021).
Bitki Doku Kültürlerinin Kurulması
Bitki doku kültürü laboratuvarı en az 4 ayrı odadan oluşmalıdır (Şekil 1) (Mather ve Roberts, 2002). Bu odalar, besi ortamının hazırlandığı, ön sterilizasyonun gerçekleştiği ve besi ortam kaplarının temizlendiği hazırlık odası, ekimin gerçekleştiği transfer odası, bitkilerin gelişimlerini gerçekleştirdiği iklim odası ve dış ortama alıştırıldığı akklimatizasyon
odası ya da serasından oluşur.
Biyoreaksiyon süreçlerinin de eklenmesi amaçlandığında biyoreaktör, ekstraksiyon cihazları kromatografi cihazlarının da olmasında fayda olacaktır (Mineo, 1990).

Bitkilerin steril şartlarda çoğaltılabilmesi için öncelikle bitkilerin ve çoğaltıldıkları kapların sterilize edilmesi gerekir. Bitkilerin yüzey sterilizasyonları için ençok kullanılan kimyasallar sodyum hipoklorid, kalsiyum hipoklorid, etanol, civaklorür, gümüş nitrat, ozon, biyositler ve fungusitlerdir. Kültür ortamına alınacak bitkiler üç kez sabunlu su ile yıkanarak durulanır.
%70 konsantrasyonda etil alkol ile 30 saniye, %20 oranında sodyum hipoklorid ile 20
dakika muamele edilir. Odunsu kısımlar, tohum ve toprak altı organlarında konsantrasyon arttırılıp, genç sürgün ve hassas bitkilerde oran azaltılabilir.
Süre sonunda steril distile su ile steril kabin altında en az üç kez durulanıp ve tabanında uygun besi ortamı bulunan besi ortam kaplarına dikimi gerçekleştir. Bitki doku kültürü yöntemleri için kullanılan ortam protokolleri bitki morfolojik durumları ve yararlandıkları
besin maddelerine uygun kompoze edilmiştir. İçerikler ayrıca bitki besin maddelerinin
antagonistik ve sinergist etkilerine uygun belirlenir.
Örneğin klor ve iyot ortamdan çekilerek asma bitkisi için Chee and Pool (1987) ve Prunus için Quoirin and Lepoivre (1977) ortamları geliştirimiştir, Rhododendron ve berry grupları için Anderson (1980). Monocotiledon anther kültürleri için Chu (N6), ortamları geliştirilmiştir. Bu gruplara tatlı patates (Chee, 1992), şekerpancarı (De Greef and Jacobs, 1979), ceviz (Drive and Kuniyuki, 1984) soya fasülyesi (Gamborg et., al., 1968), orhid (Morel, 1965), havuç ya da Pinus (Litvay, 1985), odunsu bitkiler için (Lloyd and Mc Cown, 1980), zeytin için Rugini (1993) ilave edilebilir.
Tüm bu besi ortamlarının geliştirilmesinde doku kültürü uygulamaları için çok önemli bir besi ortam içeriği bulunur. Murashige ve Skoog (1962); White (1939) ve Skoog (1944) etkilenerek tütün için geliştirdikleri MS ortamı halen pek çok bitki için kullanılmaktadır.
Bitki besi ortamlarında makro, mikro besin maddelerinin yanısıra bazı vitaminler, aminoasitler, şeker, hormonlar, organik bazı bileşikler, bitki koruma ürünleri ve katılaştırıcı bulunabilmektedir. Besi ortamının temel görevi bitkiciklerin sağlıklı gelişmesini sağlamaktır.
Geometrik artış hızıyla çoğaltım oldukça hızlıdır. Meristem kültürü yöntemiyle her bir eksplant 4 yeni sürgün oluşturduğunda, 30-40 günlük alt kültür süreçleriyle yıl sonunda yaklaşık 1 milyon klon elde edilir. Bir bitkiden elde edilecek yeni sürgün sayısı beş olduğunda ise yıl sonunda elde edilecek yaklaşık klon sayısı 10 milyon olacaktır.
Bu artış üzerinde bitki türleri etki olurken besi ortamı içeriği de çok önemlidir. Bitkilerin bitki besin maddeleri istekleri, bileşikleri alım formları, bitki büyüme düzenleyici türev ve miktarları ile bitki besin maddeleri arasında antagonist ve sinergist etkiler media bileşenleri üzerine etkilidir.
Steril şartlarda besi ortamına yerleştirilen bitkiler yapay aydınlatma altında gelişmeye bırakılır. Ortam sıcaklığı, kap içerisindeki nispi nem, aydınlatma yoğunluğu, ışık frekansı, fotoperiyod bitki gelişimi üzerine etkilidir. Örneğin heliofit bitkiler yoğun aydınlatma
yoğunluğu tercih ederken kserofit bitkiler düşük yoğunluk tercih eder.
Organ Kültür Yöntemi
Biyoaktif bileşiklerin bitkiler akümüle oldukları organlara göre üretim amaçları farklılık gösterebilir. Astragalus membranaceus bitkisinde Astraglosde IV’ün akümle oldıuğu organ kök olduğu için rejenerasyon kök Catharanthus roseus bitkisinde vinblastin ve catharanthine etken maddeleri yaprakta, Diosgenin ise Diocorea spp yumrularında akümüle
olduğu farklı organlar tercih edilir.
Bitki organ kültürleri rejenerasyonlarında bitki büyüme düzenleyicileri tercih edilirken ortamdaki besin maddesi içerikleri de rekombine edilir. Kök gelişimini sürgün rejenerasyonu için sitokinin ve giberellik asitler tercih edilirken kök rejenerasyonu için oksin türevi büyüme düzenleyiciler tercih edilir.
Yumru için chlorocholine chloride (CCC), paclobutrazol (PBZ) ve şeker konsantrasyonu arttırılabilir (Zeng, et.al., 2012). Kök rejenerasyonu için ayrıca saçak kök oluşumu
gerçekleştiren Rhizobium rhizogenes bakteri inokulasyonu mümkündür. Saçaklı kök kültürü için Catharanthus alkaloidleri, atropin ve hyoscyamine kullanılır (Shakeran, 2017).
Bitkiler doku kültürü ortamında hava ile doyurulan sıvı solüsyonlar içinde çoğalabilirler. Bu yönteme geçici daldırma yöntemi (temporary immersion system) denilmektedir (Şekil 2). Temporary immersion sistemlerinde (TIS) besi ortamına düzenli taze hava akışı sağlandığı için ideal bitki gelişimi sağlanmaktadır.
TIS’te dikkat edilmesi gereken en önemli husus steril bitkilerin bulunduğu ortama, sağlanan
hava akışı içerisinde kontaminasyon etmenlerinin bulundurulmamasıdır. TIS şu şekilde çalışır. Birbirine sıvı transferi mümkün iki steril kabın üsttekinde bitki eksplantları, alttakinde ise besin solüsyonu yer almaktadır. Alttaki kaba bağlı bir hava kompresörü
bulunur.
Hava beslemesi hepafiltreden geçirilerek sağlanır. TIS’te iki durum söz konusudur. Birinci durumda hava kompresörü çalışır, ikincisi durumda ise kompresörün sağladığı hava akışı kesilir. Hava kompresörü alt kaba temiz taze hava girişi sağladığında kabın içerisindeki media pozitif hava basıncı etkisiyle kapillar bir boru içerisinden yukarıdaki kaba
taşınır.
Üst kapta bulunan bitki parçaları taze hava ile doygun besi solüsyonu ile muamele edilir. Bir süre sonra kompresör kapalı konuma alınır. Bu durumda yer çekimin etkisiyle besi solüsyonu aşağıdaki kaba akış sağlarken bitkiler bir filtre yardımıyla üst kapta tutulur. Besi solüsyonu aşağıdaki kaba akarken dış kısımdan bir miktar hava sağlanırken açıklık üzerinde
de hepafiltre yer almalıdır. TIS yardımıyla muz, patates mikro yumru çoğaltımı mümkündür (Bello-Bello et.al., 2019, Jimenez et.al., 1999).

Doku Kültürü Yöntemi
Meristem kültürü, bakımından somaklonal varyasyonlara karşı dayanıklı olduğu için klonal mikroçoğaltım için en sık kullanılan doku kültürü metodudur.
Gövde ve yaprak üzerinde yer alan salgı dokularının en iyi örnekleri glandular trichomes
(hair) keselerdir. Salgı dokularında yer alan çoğaltıldığı volitile bileşenlerin doku kültürü yöntemleriyle çoğaltıldığı yöntemler örneklendirilebilir.
Koku bileşenleri vb. aromatic bileşenler bu yönetemle çoğaltılabilir. Drosera capensis bitkisi glandular hair’den plambagin 1,4-naphthoquinones ve 7-methyljuglone elde edilmektedir (Budzianowski, 2000).
Hücre Kültürü Yöntemi
Hücre kültürleri, kallus ya da hücre duvarları uzaklaştırılan birbirinden bağımsız hücrelerden oluşturulur. Hücre kültürüleri süspansiyon ortamında kullanılabildiği gibi katı ve yarı katı ortamlarda da kullanılabilir. Hücre kültürlerinde hücreler bağımsız olduğu için sinyal iletimleri hücre bağımsızdır ve arkadaş hücrelerinden gen expresyonu bakımından etkilenmezler.
Hücreler büyüme düzenleyicileri yardımıyla biyoaktif madde üretilen organlara rejenere edilebilir, ağır metal, elisitörler ya da ölçül biyokimyasallar ile değerli biyoaktif molekül verimleri arttılabilir. Başlangıç hücrelerinin temin edildiği dokular etken madde verimi açısından oldukça değerlidir.
Örneği, Morinda citrifolia bitkisinin farklı organlarından alınan başlangıç hücreleri anthraquinones verimi açısından farklılık göstermiştir (Deshmukh ve ark., 2011).
Bitki hücreleri, hücre süspansiyon kültürü ortamında bakteri hücreleri gibi birbirinden bağımsız hareket edebilir. Hücre süspansiyon kültürlerinde kap sürekli agitate edilir ya da temiz hava beslemesiyle hücreler hareketli tutulur. Aksi taktirde bitki hücreleri kolonileşir.
Süreç mikroorganizma kültürleriyle benzerlik gösterirken bitkiler heterotrof canlılar olduğu için besi ortamlarında bazı temel farklılıklar gözlenir. Diğer yandan süreçler biyoreaktör
gibi tam kontrollü ortam şartları sağlanabilir.
Biyoreaktör yardımıyla süspansiyon kültür ortamı içerisindeki canlı hücrelerin otonom olarak çoğaltılması mümkündür. Biyoreaktör bilgisayar ile kontrol edilen bir cihaz olup, besi ortamı içerindeki besi solüsyon beslemesi, pH, EC’yi temiz hava girişini biyoreaksiyon süreçlerini kontrol eden bir cihazdır (Şekil 3).
Süspansiyon içerindeki hedeflenen biyoaktif madde konsantrasyonu da önemlidir (Espinosa-
Leal ve ark., 2018). Hücrelerin maksimum artış miktarı ve süresi biyoreaktör ortamındda yer alan olan besi ortamının (substratın) tüketim hızına bağlı değişir.
Bunun yanında bitki hücrelerinin ortama salgıladıkları fenolik ya da toksik bileşikler de üretim periyod uzunluğunu belirler. Hücre verim stabilizasyonu biyoreaktör tipinin belirlenmesinde etkilidir (Motolinía-Alcántara ve ark., 2021).

Biyoaktif Bileşikler Metabolik Yolakları
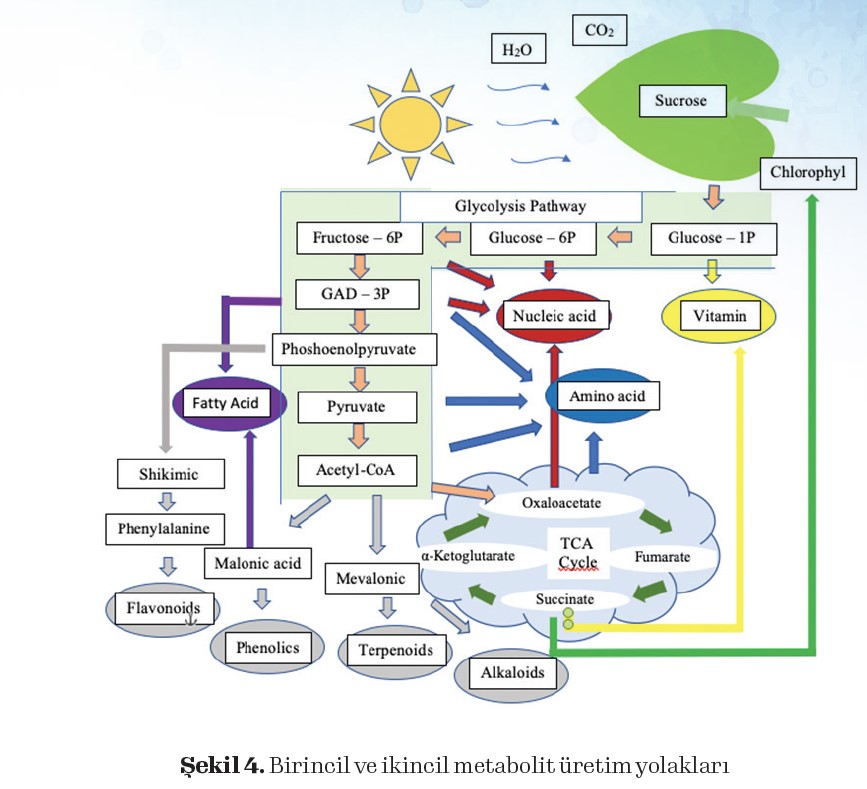
Güneş enerjisinin kimyasal bağ enerjisine dönüştürülmesiyle başlayan bitki anabolizma faaliyetleri fotosentez reaksiyonları sonucu glikoz üretimi gerçekleşir. Bu temel fonksiyonlar yeşil renk pigmenini içeren klorofil hücrelerinde gerçekleşir. Işık altında karbondioskit molekülünden elde edilen karbon ve su molekülünden elde edilen hidrojen ve oksijen
glikoz yapımında kullanılır.
Bitkiler fotosentez sayesinde inorganik materyallerden glikoz üretir. Fotosentez reaksiyonları ile üretilen glikoz, besin zincirimizdeki önemli ve temel basamağı oluşturur.
Glikoz, glycolysis pathway ile pyruvate dönüşür, pürivatın Asetil Co-A molekülüne dönüşmesi sitrik asit döngüsü için hammadde ortaya çıkmış olur.
Glycolysis Pathway ve Krebs Cycle (TCA ya da sitrik asit döngüsü), primer ve sekonder metabolitlerin üretildiği temel döngülerdir. Bu iki önemli Glycolisiz ve sitrik asit döngüsü ile nükleik asit, aminoasit, vitamin, yağ asitleri gibi primer ve sekonder metabolit yolakları
oluşur.
Örneğin Phoshoenolpyruvate, Shikimic asit döngüsüne girdi oluşturuken bu döngü sonunda flavonidler üretilmektedir. Glycolysis pathway’in son ürünü Asetil CoA ise Krebs döngüsünün hammaddesini oluşturması yanında Malonic asit döngüsü ile fenolik bileşiklerin ve mevalonik döngüsü ile terpen ve alkoloidleri oluşturacak reaksiyonların hammaddesi
oluşur.
TCA ya da Krebs döngüleri kullanılarak bazı bitkisel aminoasit ve nükleik asitlerin bitki hücresindeki derişim oranları doğal yollarla artırılabilir (Şekil 4) (Zhang ve Fernie, 2018; Alabduladhem ve Bordoni, 2021).
Bitki biyoaktif maddelerinin bitkisel biyoaktif bileşenler amaçlı kullanılması için farmakolojik etkisinin incelenmesi ve klinik çalışmalarla test edilmesi gereklidir. Tekrarlı denemelerde placebo örneklere göre istatistiksel olarak üstünlük sağlamalıdır. Diğer yandan bitkisel ilaç ürünlerin botanik, fiziksel, kimyasal ve biyolojik açıdan standardize edilmesi gereklidir.
Aktif maddelerinden yararlanılacak bitkisel ürünün renk, koku, tat, tekstür, fraktür,
kalitatif ve kantitatif yönden botanik; nem içeriği, çözünürlük, kül, spektroskopik açıdan fiziksel; mikrobiyal, farmakolojik ve toksikolojik yönünden biyolojik; kromatografik açıdan da kimyasal olarak standardize edilmesi gerekir (Shivatare, 2013).
Sonuç
Bitki droglarının katma değeri yüksek bitkisel biyoaktif bileşenler olarak değerlendirilebilmesi için içeriklerinde yer alan biyokimyasal kompozisyonun standardize edilmesi gerekir. İyi üretim uygulama standartları (GMP)’nın gerçekleştirilebilmesi için konvansiyonel üretim yanında doku organ, doku ve hücre kültürü uygulamalarının hayata geçirilmesi mümkündür.
Doku kültürü uygulamaları ile standart hammadde temini üretim sürekliği ve yüksek kalite standartları sağladığı gibi, yüksek yatırım maliyeti, eğitimli personel gereksinimi ve steril koşulların da düzenli olarak korunarak kontrol altında tutulması gerekir. Gelişen teknoloji ile
bu uygulamaların uygulama sıklığı günden güne artmaktadır.
Türkiye’nin diğer tüm inovatif başarılarında olduğu gibi biyoteknoloji uygulamalarından faydalanarak bitkisel biyoaktif bileşenlerinin ülkemizde üretebilmesi, doğal florasındaki bitki zenginliğini laboratuvar şartlarına taşıyıp, teknik tecrübelerini de bu alanda değerlendirmesi ile mümkün olabilir.
Tarımsal biyoteknoloji, yüksek katma değerli bir yatırım alanıdır. İlgili alanda çalışan araştırıcı ve sanayicilerin bir araya gelip, yatırım destek ve teşvik mekanizmalarının da bu alana yönlendirilmesiyle, dünya pazarında çok kısa sürede rekabet edebilir konuma gelmemiz sağlanabilir.
Kaynaklar
• Başer H.C, 2012. Bitkisel Drogların Standart / Farmakope Monografları. MİSED; 27-28.
• Bello-Bello J.J., Cruz-Cruz C.A., Pérez-Guerra J.C., 2019. A new Temporary İmmersion System For Commercial Micropropagation of Banana (Musa AAA cv. Grand Naine). In Vitro Cellular & Developmental Biology- Plant 55: 313–320.
• Budzianowski J., 2000. Naphthoquinone glucosides of Drosera gigantean from in vitro cultures Planta Medica 66,667-669.
• Chee R. P., Leskovar D. I., Cantliffe D. J., 1992. Optimizing Embryogenic Callus and Embryo Growth of a Synthetic Seed System for Sweet.
• De Greef W. and Jacobs M., 1979. In Vitro Culture of The Sugarbeet: Description of A Cell Line With High Regeneration Capacity., Plant Science Letters., 17, 55-61.
• Deshmukh S.R. , Wadegaonkar V.P. , Bhagat R.P. and Wadegaonkar P.A., 2011. Tissue Specific Expression of Anthraquinones, Flavonoids and Phenolics in Leaf, Fruit and Root Suspension Cultures of Indian Mulberry (Morinda citrifola L.). Plant Omics Journal 4(1):6-13.
• Driver, J.A., Kuniyuki, A.H. 1984. In Vitro Propagation of Paradox Walnut Rootstock, Hort. Science, 19(4): 507-509.
• Espinosa-Leal C.A., Puente-Garza C.A., and García-Laracorresponding S., 2018. In Vitro Plant Tissue Culture: Means for Production of Biological Active Compounds. Planta 248(1):1-8.
• Espinosa-Leal C.A., Puente-Garza C.A., and García-Laracorresponding S., 2018. In Vitro Plant Tissue Culture: Means for Production of Biological Active Compounds. Planta 248(1):1-8.
• Feher A., 2019. Callus, Dedifferentiation, Totipotency, Somatic Embryogenesis: What These Terms Mean in the Era of Molecular Plant Biology?. Frontiers in Plant Science 10:516: 1-11.
• Gamborg O.L., Miller R.A., Ojima K., 1968. Nutrient Requirement of Suspensions Cultures of Soybean Root Cells. Exp. Cell Res., 150,151.
• Litvay J.D., Verma D.C., Morris A.J., 1985. Influence of A Loblolly Pine (Pinus taedia L.) Culture Medium and Its Components on Growth and Somatic Embryogenesis of The Wild Carrot (Daucus carota L.). Plant Cell Rep 4: 325 – 328.
• Lloyd G. and McCown B., 1980. Commercially-Feasible Micropropagation of Mountain Laurel, Kalmia latifolia, by Use of Shoot-Tip Culture. Combined Proceedings - International Plant Propagators’ Society, 30:421, 427.
• Mather J.P. and Roberts P.E., Introduction to Cell and Tissue Culture-Theory and Technique. Plenum Press, New York: p.239.
• Mineo, L. 1990. Plant Tissue Culture Techniques. İn Tested Studies for Laboratory Teaching. 11. Edit. C. A. Goldman, (ABLE): 151-174.
• Morel, GM. 1965. Clonal Propagation of Orchids by Meristem Culture. Cymb.Soc. News 20:3-11.
• Motolinía-Alcántara E.A., Castillo-Araiza C.O Rodríguez-Monroy N., RománGuerrero A., Cruz- Sosa F., 2021. Engineering Considerations to Produce Bioactive Compounds from Plant Cell Suspension Culture in Bioreactors. Plants (Basel) 10(12): 2762.
• Motolinía-Alcántara E.A., Castillo-Araiza C.O Rodríguez-Monroy N., RománGuerrero A., Cruz-Sosa F., 2021. Engineering Considerations to Produce Bioactive Compounds from Plant Cell Suspension Culture in Bioreactors. Plants (Basel) 10(12): 2762.
• Shakeran Z., Keyhanfar M., and Ghanadian M., 2017. Biotic Elicitation for Scopolamine Production by Hairy Root Cultures of Datura metel. Mol Biol Res Commun. 6(4): 169–179.
• Shivatare R. S., Nagore D. Nipanikar S., 2013. ‘HPTLC’ an important tool in standardization of herbal medical product: A review. JSIR 2013; 2(6): 1086-1096.
• Wawrosch C and Zotchev S. B., 2021. Production of Bioactive Plant Secondary Metabolites Through In Vitro Technologies-Status and Outlook. Appl. Microbiol Biotechnol. 2021; 105(18): 6649–6668.
• Yu M., Gouvinhas I., Rocha J., Barros A. I. R. N. A. 2021. Phytochemical and Antioxidant Analysis of Medicinal And Food Plants Towards Bioactive Food and Pharmaceutical Resources. Plant and Cell Physiology, 45(5(: 543–549.
• Zhang Y. and Fernie A.R., 2018. On The Role of The Tricarboxylic Acid Cycle In Plant Productivity Journal of Integrative Plant Biology 60(12): 1199-1216.
• Zheng, R., Wu, Y., Xia Y., 2012. Chlorocholine chloride and paclobutrazol treatments promote carbohydrate accumulation in bulbs of Lilium Oriental hybrids ‘Sorbonne’. J Zhejiang Univ Sci B., 13(2): 136–144.
• Bu çalışma Türkmen O.S., 2022. Production of Plant Bioactıve Compounds With Plant Organ, Tıssue and Cell Culture Techniques; Compendium Of Advances in Agrıculture. IKSAD Publication: 23-46 isimli eserin bir bölümünden yararlanılarak
hazırlanmıştır.
Dr. Öğr. Üyesi Onur Sinan Türkmen Çanakkale Onsekiz Mart Üniversitesi
Ziraat Fakültesi, Tarla Bitkileri Bölümü
Margeght Biyoteknoloji San. ve Tic. Ltd. Şti.
Çanakkale Teknopark
Melike Küçük Çanakkale Onsekiz Mart Üniversitesi
Ziraat Fakültesi, Tarla Bitkileri Bölümü
Margeght Biyoteknoloji San. ve Tic. Ltd. Şti.
Çanakkale Teknopark

 Bitkilerin steril şartlarda çoğaltılabilmesi için öncelikle bitkilerin ve çoğaltıldıkları kapların sterilize edilmesi gerekir. Bitkilerin yüzey sterilizasyonları için ençok kullanılan kimyasallar sodyum hipoklorid, kalsiyum hipoklorid, etanol, civaklorür, gümüş nitrat, ozon, biyositler ve fungusitlerdir. Kültür ortamına alınacak bitkiler üç kez sabunlu su ile yıkanarak durulanır.
%70 konsantrasyonda etil alkol ile 30 saniye, %20 oranında sodyum hipoklorid ile 20
dakika muamele edilir. Odunsu kısımlar, tohum ve toprak altı organlarında konsantrasyon arttırılıp, genç sürgün ve hassas bitkilerde oran azaltılabilir.
Süre sonunda steril distile su ile steril kabin altında en az üç kez durulanıp ve tabanında uygun besi ortamı bulunan besi ortam kaplarına dikimi gerçekleştir. Bitki doku kültürü yöntemleri için kullanılan ortam protokolleri bitki morfolojik durumları ve yararlandıkları
besin maddelerine uygun kompoze edilmiştir. İçerikler ayrıca bitki besin maddelerinin
antagonistik ve sinergist etkilerine uygun belirlenir.
Örneğin klor ve iyot ortamdan çekilerek asma bitkisi için Chee and Pool (1987) ve Prunus için Quoirin and Lepoivre (1977) ortamları geliştirimiştir, Rhododendron ve berry grupları için Anderson (1980). Monocotiledon anther kültürleri için Chu (N6), ortamları geliştirilmiştir. Bu gruplara tatlı patates (Chee, 1992), şekerpancarı (De Greef and Jacobs, 1979), ceviz (Drive and Kuniyuki, 1984) soya fasülyesi (Gamborg et., al., 1968), orhid (Morel, 1965), havuç ya da Pinus (Litvay, 1985), odunsu bitkiler için (Lloyd and Mc Cown, 1980), zeytin için Rugini (1993) ilave edilebilir.
Tüm bu besi ortamlarının geliştirilmesinde doku kültürü uygulamaları için çok önemli bir besi ortam içeriği bulunur. Murashige ve Skoog (1962); White (1939) ve Skoog (1944) etkilenerek tütün için geliştirdikleri MS ortamı halen pek çok bitki için kullanılmaktadır.
Bitki besi ortamlarında makro, mikro besin maddelerinin yanısıra bazı vitaminler, aminoasitler, şeker, hormonlar, organik bazı bileşikler, bitki koruma ürünleri ve katılaştırıcı bulunabilmektedir. Besi ortamının temel görevi bitkiciklerin sağlıklı gelişmesini sağlamaktır.
Geometrik artış hızıyla çoğaltım oldukça hızlıdır. Meristem kültürü yöntemiyle her bir eksplant 4 yeni sürgün oluşturduğunda, 30-40 günlük alt kültür süreçleriyle yıl sonunda yaklaşık 1 milyon klon elde edilir. Bir bitkiden elde edilecek yeni sürgün sayısı beş olduğunda ise yıl sonunda elde edilecek yaklaşık klon sayısı 10 milyon olacaktır.
Bu artış üzerinde bitki türleri etki olurken besi ortamı içeriği de çok önemlidir. Bitkilerin bitki besin maddeleri istekleri, bileşikleri alım formları, bitki büyüme düzenleyici türev ve miktarları ile bitki besin maddeleri arasında antagonist ve sinergist etkiler media bileşenleri üzerine etkilidir.
Steril şartlarda besi ortamına yerleştirilen bitkiler yapay aydınlatma altında gelişmeye bırakılır. Ortam sıcaklığı, kap içerisindeki nispi nem, aydınlatma yoğunluğu, ışık frekansı, fotoperiyod bitki gelişimi üzerine etkilidir. Örneğin heliofit bitkiler yoğun aydınlatma
yoğunluğu tercih ederken kserofit bitkiler düşük yoğunluk tercih eder.
Bitkilerin steril şartlarda çoğaltılabilmesi için öncelikle bitkilerin ve çoğaltıldıkları kapların sterilize edilmesi gerekir. Bitkilerin yüzey sterilizasyonları için ençok kullanılan kimyasallar sodyum hipoklorid, kalsiyum hipoklorid, etanol, civaklorür, gümüş nitrat, ozon, biyositler ve fungusitlerdir. Kültür ortamına alınacak bitkiler üç kez sabunlu su ile yıkanarak durulanır.
%70 konsantrasyonda etil alkol ile 30 saniye, %20 oranında sodyum hipoklorid ile 20
dakika muamele edilir. Odunsu kısımlar, tohum ve toprak altı organlarında konsantrasyon arttırılıp, genç sürgün ve hassas bitkilerde oran azaltılabilir.
Süre sonunda steril distile su ile steril kabin altında en az üç kez durulanıp ve tabanında uygun besi ortamı bulunan besi ortam kaplarına dikimi gerçekleştir. Bitki doku kültürü yöntemleri için kullanılan ortam protokolleri bitki morfolojik durumları ve yararlandıkları
besin maddelerine uygun kompoze edilmiştir. İçerikler ayrıca bitki besin maddelerinin
antagonistik ve sinergist etkilerine uygun belirlenir.
Örneğin klor ve iyot ortamdan çekilerek asma bitkisi için Chee and Pool (1987) ve Prunus için Quoirin and Lepoivre (1977) ortamları geliştirimiştir, Rhododendron ve berry grupları için Anderson (1980). Monocotiledon anther kültürleri için Chu (N6), ortamları geliştirilmiştir. Bu gruplara tatlı patates (Chee, 1992), şekerpancarı (De Greef and Jacobs, 1979), ceviz (Drive and Kuniyuki, 1984) soya fasülyesi (Gamborg et., al., 1968), orhid (Morel, 1965), havuç ya da Pinus (Litvay, 1985), odunsu bitkiler için (Lloyd and Mc Cown, 1980), zeytin için Rugini (1993) ilave edilebilir.
Tüm bu besi ortamlarının geliştirilmesinde doku kültürü uygulamaları için çok önemli bir besi ortam içeriği bulunur. Murashige ve Skoog (1962); White (1939) ve Skoog (1944) etkilenerek tütün için geliştirdikleri MS ortamı halen pek çok bitki için kullanılmaktadır.
Bitki besi ortamlarında makro, mikro besin maddelerinin yanısıra bazı vitaminler, aminoasitler, şeker, hormonlar, organik bazı bileşikler, bitki koruma ürünleri ve katılaştırıcı bulunabilmektedir. Besi ortamının temel görevi bitkiciklerin sağlıklı gelişmesini sağlamaktır.
Geometrik artış hızıyla çoğaltım oldukça hızlıdır. Meristem kültürü yöntemiyle her bir eksplant 4 yeni sürgün oluşturduğunda, 30-40 günlük alt kültür süreçleriyle yıl sonunda yaklaşık 1 milyon klon elde edilir. Bir bitkiden elde edilecek yeni sürgün sayısı beş olduğunda ise yıl sonunda elde edilecek yaklaşık klon sayısı 10 milyon olacaktır.
Bu artış üzerinde bitki türleri etki olurken besi ortamı içeriği de çok önemlidir. Bitkilerin bitki besin maddeleri istekleri, bileşikleri alım formları, bitki büyüme düzenleyici türev ve miktarları ile bitki besin maddeleri arasında antagonist ve sinergist etkiler media bileşenleri üzerine etkilidir.
Steril şartlarda besi ortamına yerleştirilen bitkiler yapay aydınlatma altında gelişmeye bırakılır. Ortam sıcaklığı, kap içerisindeki nispi nem, aydınlatma yoğunluğu, ışık frekansı, fotoperiyod bitki gelişimi üzerine etkilidir. Örneğin heliofit bitkiler yoğun aydınlatma
yoğunluğu tercih ederken kserofit bitkiler düşük yoğunluk tercih eder.


 Bitki biyoaktif maddelerinin bitkisel biyoaktif bileşenler amaçlı kullanılması için farmakolojik etkisinin incelenmesi ve klinik çalışmalarla test edilmesi gereklidir. Tekrarlı denemelerde placebo örneklere göre istatistiksel olarak üstünlük sağlamalıdır. Diğer yandan bitkisel ilaç ürünlerin botanik, fiziksel, kimyasal ve biyolojik açıdan standardize edilmesi gereklidir.
Aktif maddelerinden yararlanılacak bitkisel ürünün renk, koku, tat, tekstür, fraktür,
kalitatif ve kantitatif yönden botanik; nem içeriği, çözünürlük, kül, spektroskopik açıdan fiziksel; mikrobiyal, farmakolojik ve toksikolojik yönünden biyolojik; kromatografik açıdan da kimyasal olarak standardize edilmesi gerekir (Shivatare, 2013).
Bitki biyoaktif maddelerinin bitkisel biyoaktif bileşenler amaçlı kullanılması için farmakolojik etkisinin incelenmesi ve klinik çalışmalarla test edilmesi gereklidir. Tekrarlı denemelerde placebo örneklere göre istatistiksel olarak üstünlük sağlamalıdır. Diğer yandan bitkisel ilaç ürünlerin botanik, fiziksel, kimyasal ve biyolojik açıdan standardize edilmesi gereklidir.
Aktif maddelerinden yararlanılacak bitkisel ürünün renk, koku, tat, tekstür, fraktür,
kalitatif ve kantitatif yönden botanik; nem içeriği, çözünürlük, kül, spektroskopik açıdan fiziksel; mikrobiyal, farmakolojik ve toksikolojik yönünden biyolojik; kromatografik açıdan da kimyasal olarak standardize edilmesi gerekir (Shivatare, 2013).